分析:(1)16.0吨的氧化钡在足量的氧气中加热反应后,固体的质量变为17.6吨,质量增重为参加反应是氧气的质量,据此根据方程式计算实际参加反应的氧化钡的质量;
(2)假定水为100g,则溶解3.9gBa(OH)
2?8H
2O,故溶液的质量为103.9g,根据化学式中氢氧化钡的质量分数计算3.9g氢氧化钡晶体中含有氢氧化钡的质量,再根据质量分数定义计算;
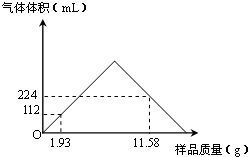
(3)最高点时,盐酸与氢氧化钡、碳酸钡恰好反应,最高点之前,盐酸有剩余,最高点之后氢氧化钡完全反应、碳酸钡有剩余,至横轴时氢氧化钡与盐酸恰好反应,碳酸钡不反应,
①、加入样品1.93生成气体112mL为二氧化碳,根据n=
计算二氧化碳的物质的量,根据碳原子守恒计算碳酸钡的物质的量,根据定组成计算11.58g混合物中含有的碳酸钡的物质的量,进而根据m=nM计算碳酸钡的质量;
②、根据①中碳酸钡的质量计算11.58g混合物中含有的氢氧化钡晶体的质量.加入样品11.58g生成气体224mL二氧化碳,根据n=
计算二氧化碳的物质的量,计算生成二氧化碳消耗的盐酸的物质的量,进而计算与氢氧化钡反应消耗的盐酸的物质的量,可得氢氧化钠晶体的物质的量,进而计算氢氧化钡晶体中n的值;
(4)①、假定二氧化碳为1mol,则混合气体共9mol,生成1mol二氧化碳的同时生成2mol,故生成CO的反应中CO、水的总物质的量为9mol-1mol-2mol=6mol,根据方程式可以计算生成CO的物质的量,进而计算混合物水的物质的量,再根据
=
计算;
②、高温气体中CO的体积分数为0.02,由方程式可知产生CO反应中生成水所在的体积分数为0.04,故生成二氧化碳反应中产生的气体占有的体积分数为1-0.02-0.04=0.94,由方程式可知,二氧化碳的体积分数为0.94×
,据此计算混合气体中二氧化碳与CO的物质的量之比,根据转化的甲烷计算二氧化碳、CO的物质的量,结合方程式计算BaS的物质的量,进而计算其质量.
解答:
解:(1)16.0吨的氧化钡在足量的氧气中加热反应后,固体的质量变为17.6吨,故参加反应是氧气的质量为17.6吨-16吨=1.6吨,则:2BaO+O
22BaO
2 2×153 32
m 1.6吨
所以m=
=15.3吨
故答案为:15.3;
(2)假定水为100g,则溶解3.9gBa(OH)
2?8H
2O,故溶液的质量为103.9g,3.9g氢氧化钡晶体中含有氢氧化钡的质量为3.9g×
=2.117g,20℃时,Ba(OH)
2饱和溶液的质量分数为
=0.02,
故答案为:0.02;
(3)最高点时,盐酸与氢氧化钡、碳酸钡恰好反应,最高点之前,盐酸有剩余,最高点之后氢氧化钡完全反应、碳酸钡有剩余,至横轴时氢氧化钡与盐酸恰好反应,碳酸钡不反应,
①、加入样品1.93生成气体112mL为二氧化碳,二氧化碳的物质的量为
=0.005mol,根据碳原子守恒可知碳酸钡的物质的量为0.005mol,故11.58g混合物中含有的碳酸钡的物质的量为0.005mol×
=0.03mol,故11.58g样品中BaCO
3的质量为0.03mol×197g/mol=5.91g,
答:11.58g样品中BaCO
3的质量为5.91g;
②、11.58g混合物中含有的氢氧化钡晶体的质量为11.58g-5.91g=5.57g.加入样品11.58g生成气体224mL二氧化碳,二氧化碳的物质的量为
=0.01mol,故生成二氧化碳消耗的盐酸的物质的量为0.01mol×2=0.02mol,与氢氧化钡反应消耗的盐酸的物质的量为0.08L×1mol/L-0.02mol=0.06mol,故氢氧化钠晶体的物质的量为0.06mol×
=0.03mol,故0.03×(171+18n)=5.57,解得n=1,
答:化学式Ba(OH)
2?nH
2O中n的值为1;
(4)①、假定二氧化碳为1mol,则混合气体共9mol,生成1mol二氧化碳的同时生成2mol,故生成CO的反应中CO、水的总物质的量为9mol-1mol-2mol=6mol,根据方程式可知生成CO的物质的量为6mol×
=2mol,故混合物水的物质的量为9mol-1mol-2mol=6mol,故混合气体的平均相对分子质量为
=23.11,
答:该反应条件下混合气体的平均式量23.11;
②、高温气体中CO的体积分数为0.02,由方程式可知产生CO反应中生成水所在的体积分数为0.04,故生成二氧化碳反应中产生的气体占有的体积分数为1-0.02-0.04=0.94,由方程式可知,二氧化碳的体积分数为0.94×
,故混合气体中二氧化碳与CO的物质的量之比为0.94×
:0.02=47:3,转化的甲烷物质的量为2.0×10
6 mol×95%,由碳元素守恒可知,二氧化碳、CO的总的物质的量为2.0×10
6 mol×95%,故二氧化碳为2.0×10
6 mol×95%×
,CO物质的量为2.0×10
6 mol×95%×
,结合方程式可知生成BaS的物质的量为2.0×10
6 mol×95%×
+2.0×10
6 mol×95%×
×
=2.0×10
6×95%×
mol,故生成BaS的质量为2.0×10
6×95%×
mol×169g/mol=316.28×10
6 g=316.28吨,
答:能生产316.28吨BaS.

 含钡化合物在实验室和工业生产中都有广泛的用途.
含钡化合物在实验室和工业生产中都有广泛的用途.

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案 [化学-物质结构与性质]
[化学-物质结构与性质] I.飞机尾气中的NO会破坏臭氧层.利用催
I.飞机尾气中的NO会破坏臭氧层.利用催


 维生素C是人体维持正常生命过程所必需的一种物质,主要来源于新鲜的蔬菜和水果中,其结构如图.下列关于维生素C的说法中正确的是( )
维生素C是人体维持正常生命过程所必需的一种物质,主要来源于新鲜的蔬菜和水果中,其结构如图.下列关于维生素C的说法中正确的是( )