
����Ŀ����ϩ�Ƿdz���Ҫ���л����ش��������⣺
��1����ϩ�����ŵ�������___________________��
��2���û�ѧ����ʽ��ʾ��ϩ�����ֲ�ͬ�������ʣ��л����ýṹ��ʽ��ʾ��
��_______________________________��
��___________________________��
��___________________________��
��3���������ϩ����ȼ�ϵ�أ�KOH�����Һ��д����������Ӧʽ��
����_________________________��
����_________________________��
��4�������ȼ�գ��γ�ԭ��ص����˵����ȷ���� ��
A. �γ�ԭ��غ����������ʸ���
B. ��ظ����л��������û��
C. ��ع���ʱ�����ҺpH����
D. �����缫���Ͽ�����ͬ
��5�������ѽ��������ַ�ʽ����ͬʱ���С�һ���ѽ�Ϊ��ϩ�����飻�����ѽ�Ϊ����ͱ�ϩ������1mol���飬�����ѽ⣬һ��ʱ���û�������к�����0.4mol����ʱ�������ƽ����Է�������Ϊ ��
���𰸡���1��̼̼˫����1�֣�
��2����C2H4+3O2![]() 2C O2+2H2O��2�֣�
2C O2+2H2O��2�֣�
��CH2��CH2+H2![]() CH3CH3��2�֣�
CH3CH3��2�֣�
��nCH2=CH2![]()
![]() ��2�֣��������𰸺������ɣ�
��2�֣��������𰸺������ɣ�
��3��������3O2+12e��+6H2O��12OH����2�֣�(����Ҳ����)
������C2H4-12e��+16OH����2CO32��+10H2O��2�֣�
��4��AD��2�֣���5��36.25��2�֣�
��������
�����������1����ϩ���еĹ����ŵ�������̼̼˫����
��2������ϩ�ǿ�ȼ�����壬��ȫȼ�յķ���ʽΪC2H4+3O2![]() 2C O2+2H2O��
2C O2+2H2O��
����ϩ����̼̼˫�������Է����ӳɷ�Ӧ������CH2��CH2+H2![]() CH3CH3��
CH3CH3��
����ϩ����̼̼˫�������Է����ӳɷ�ӦnCH2=CH2![]()
![]() ��
��
��3���������ϩ����ȼ�ϵ�أ�KOH�����Һ��������ϩ�ڸ���ͨ�룬�缫��ӦʽΪC2H4-12e��+16OH����2CO32��+10H2O������ͨ���������缫��ӦʽΪ3O2+12e��+6H2O��12OH����
��4��A.�����ȼ�գ��γ�ԭ��غ����������ʸ�����A��ȷ��B. ��ظ����������������B����C. ��ع���ʱ���������������ҺpH��С��C����D. �����缫���Ͽ�����ͬ��D��ȷ����ѡAD��
��5�����ѽ�Ϊ��ϩ������Ķ�����xmol���ѽ�Ϊ����ͱ�ϩ�Ķ�����ymol����x+y��0.6����ϩ���������xmol������ͱ�ϩ����ymol�����Դ�ʱ�������ƽ����Է���������![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.1 mol Na2CO3�����������õ�һ�����Ϊ1 L����Һ����Һ�в�������pH�Ĺ�ϵ����ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ���ǣ� ��
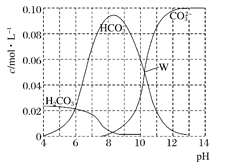
A. W����ʾ����Һ�У�c(Na+)+c(H+)=2c(CO32��)+c(OH��)+c(Cl��)
B. pH=4����Һ�У�c(H2CO3)+c(HCO3��)+c(CO32��)<0.1mol��L��1
C. pH=8����Һ�У�c(H+)+c(H2CO3)+c(HCO3��)=c(OH��)+c(Cl��)
D. pH=11����Һ�У�c(Na+)>c(Cl��)>c(CO32��)>c(HCO3��)>c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������ƿ����ˮ����Һ©���ڵ�Һ��Ҳ��ˮ�����ձ��ڵμ�ˮʱ������U�ι� ��Һ���������ƣ��ָ���ԭ�¶Ⱥ�Һ��������ұ�����ƽ�����ձ��ڵ������ǣ� ��
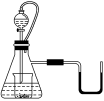
A���������� B��������
C���� D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��ж�Ӧ��ϵ��ȷ����
A | CH3CH3 + Cl2 CH2=CH2 + HCl | ��Ϊȡ����Ӧ |
B | ����֬�Ʒ��� �ɵ��۵õ������� | ��������ˮ�ⷴӦ |
C | Cl2 + 2Br = 2Cl + Br2 Zn + Cu2+ = Zn2+ + Cu | ��Ϊ���ʱ���ԭ���û���Ӧ |
D | 2Na2O2 + 2H2O = 4NaOH + O2�� Cl2 + H2O = HCl + HClO | ��Ϊˮ����ԭ����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������0.100mol/L NaOH ��Һ�ֱ�ζ�20.00mL 0.100mol/L������ʹ������ζ�������ͼ��ʾ������˵����ȷ������ ��

A����ֱ��ʾ����ʹ���ĵζ�����
B��pH=7ʱ������������NaOH��Һ��������
C��V��NaOH��=10.00 mL ʱ,![]()
D��V��NaOH��=20.00 mL ʱ��c��Cl������c��CH3COO����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̼����(Na2CO4)�к��������������ƣ��ס�����λͬѧ����ȡһ�������ĸ���Ʒ����������ͼ��ʾ�����ⶨ��Ʒ�Ĵ��ȡ�
����������˳��ͬѧ������������������������ͬѧ������������
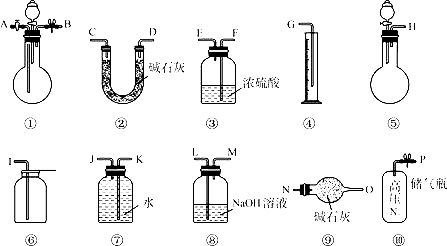
��֪����̼����(Na2CO4)���������Ʒֱ������ϡ���ᷴӦ�Ļ�ѧ����ʽ���£�
2Na2CO4+2H2SO4=2Na2SO4+2CO2��+O2��+2H2O
2Na2O2+2H2SO4=2Na2SO4+O2��+2H2O
�� ��ͬѧ��ͨ��ʵ���õ������� ����ѡ�õ�װ�� (�����) ��û�б�Ҫ�ġ�ʵ���м�ͬѧ����������ΪV L (20 ����1����ѹ)������ʱ��δ��V L���㵽��״���������õ���Na2CO4����������____________(����ƫ��������ƫ����)
�� ��ͬѧ��ͨ��ʵ���õ������� ��������õ����ݼ������ʵ�����п���ƫ�ߣ�ԭ����_________��Ҳ�п���ƫ�ͣ�ԭ����
�� Ϊ�˲��ȷ��ʵ�����ݣ����㽫��ͬѧ��ʵ����ƽ��иĽ���д������ѡ������������˳��(ÿ���������ʹ��һ�Σ�Ҳ���Բ���) (�����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ����ƣ�����ȷ���Ǵ�������ǣ� ��
A. ������ B. �������� C. ��ϩ D. ���ױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�����������ʵ��װ�á�ʵ��ʱ���ȶϿ�K2���պ�K1�������������ݲ�����һ��ʱ��Ͽ�K1���պ�K2�����ֵ�����ָ��ƫת�������й�������ȷ����
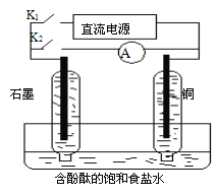
A���Ͽ�K2���պ�K1ʱ���ܷ�Ӧ�����ӷ���ʽΪ��2H++2Cl��![]() Cl2��+H2��
Cl2��+H2��
B���Ͽ�K2���պ�K1ʱ��ʯī�缫������Һ���
C���Ͽ�K1���պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦΪ��Cl2+2e����2Cl��
D���Ͽ�K1���պ�K2ʱ��ʯī�缫������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaCl��BaCl2��ɵĻ����Һ100 mL,��Ϊ���ȷ�,������һ���м���50mL 0.60 mol��L-1��AgNO3��Һ��ʹ��Һ�е�Cl-������ȫ;����һ����Һ�м���50 mL 0.20 mol��L-1��ϡ�����ʹBa2+�պó�����ȫ����ԭ��Һ��c��Na+������λ:mol��L-1��Ϊ�� ��
A. 0.1 B. 0.2 C. 0.4 D. 0.02
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com