
【题目】硫代硫酸钠俗称保险粉,实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠。
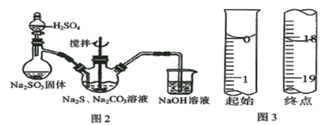
(1)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是____________,三颈烧瓶中发生反应的化学方程式______________。
(2)保险粉样品中Na2S2O3·5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol·L-1碘的标准溶液进行滴定。请回答:
①到达滴定终点的标志_______________。
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为____mL,产品的纯度为______________(设Na2S2O3·5H2O相对分子质量为M)。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的纯度的测量结果___________(填“偏高”、“偏低”或“不变”)。
(3)某研究小组以硫代硫酸钠与硫酸反应来探究外界条件对反应速率的影响,设计实验如下:
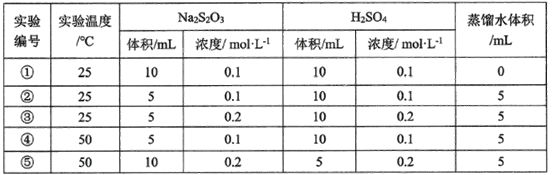
下列有关说法不正确的是__________________
A.该同学在实验中采用的研究方法是实验比较法
B实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
C.实验①和③溶液变浑浊的时间相同
D.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
【答案】蒸馏烧瓶 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 溶液变为蓝色,且30s内不恢复原色 18.10 ![]() 偏低 CD
偏低 CD
【解析】
(1)根据仪器的结构和性能确定盛放Na2SO3固体的玻璃仪器名称;三颈烧瓶中发生的反应是SO2通入Na2S和Na2CO3的混合溶液中生成硫代硫酸钠;
(2)①用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇淀粉变蓝指示反应终点;
②终点读数与起点读数之差为消耗碘的标准溶液体积,根据方程式计算;
③局部变色就停止滴定,消耗标准溶液体积偏小,测定结果偏低;
(3)A.采取控制变量法对比实验探究外界条件对反应速率的影响;
B.实验①、②的温度相等,c(H2SO4)相等,c(Na2S2O3)不相等,故实验①、②是探究浓度对化学反应速率的影响;
C.实验①、③的温度相等,c(Na2S2O3)相等,c(H2SO4)不相等,反应速率不相等;
D.实验③、⑤温度不相等,c(H2SO4)和c(Na2S2O3)也均不相等。
(1) 盛放Na2SO3固体的玻璃仪器是蒸馏烧瓶,三颈烧瓶中SO2通入Na2S和Na2CO3的混合溶液中生成硫代硫酸钠时发生反应的化学方程式为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;
(2)①用配制的碘溶液滴定硫代硫酸钠,滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色,说明反应到达终点;
②终点读数为18.10mL,起点读数为0.00mL,故消耗碘的标准溶液体积为18.10mL,
设Na2S2O35H2O的纯度为x,则:
2Na2S2O35H2O~2Na2S2O3~I2
2Mg 1mol
Wxg 18.10×10-3L×0.1000molL-1
故2Mg:Wxg=1mol:18.10×10-3L×0.1000molL-1,解得x=![]() %;
%;
③局部变色就停止滴定,消耗标准溶液体积偏小,会使样品中Na2S2O35H2O的纯度的测量结果偏低;
(3)A.采取控制变量法对比实验探究外界条件对反应速率的影响,故A正确,
B.实验①、②的温度相等,c(H2SO4)相等,c(Na2S2O3)不相等,故实验①、②是探究浓度对化学反应速率的影响,故B正确;
C实验①、③的温度相等,c(Na2S2O3)相等,c(H2SO4)不相等,③中c(H2SO4)较大,反应速率较快,变浑浊时间较短,故C错误;
D探究温度对化学反应速率的影响,应保证物质的浓度相等,而实验③、⑤温度不相等,c(H2SO4)和c(Na2S2O3)也均不相等,实验②、④中c(H2SO4)和c(Na2S2O3)均相等,但温度不等,故实验②、④是探究温度对化学反应速率的影响,故D错误;
故答案为CD。


科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是
A. 钢铁在潮湿的空气中容易生锈
B. 棕红色NO2加压后颜色先变深后变浅
C. 高温及加入催化剂都能使合成氨的反应速率加快
D. H2、I2、HI平衡混合气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是( )

A.湿润的蓝色石蕊试纸先变红后褪色
B.湿润的品红试纸褪色,证明SO2具有漂白性
C.湿润的淀粉-KI试纸未变蓝,说明SO2的氧化性强于I2
D.蘸有酸性KMnO4溶液的滤纸褪色,证明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L1表示),写出计算过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.lmol·L-1H2A溶液中滴加0.lmol·L-1NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是( )

A. H2A在水中的第一步电离的电离方程式为:H2A=HA-+H+
B. c(HA-)/c(H2A)的比值随着V[NaOH(aq)]的增大而减小
C. V[NaOH(aq)]=20mL 时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol·L-1
D. V[NaOH(aq)]=20mL 时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下能大量共存的是 ( )
A.在c(HCO![]() )="0.1" mol·L-1的溶液中:NH
)="0.1" mol·L-1的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.有大量![]() 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量![]() 存在的强酸性溶液中:NH
存在的强酸性溶液中:NH![]() 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO![]() 、S2-、Na+、K+
、S2-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X不可能是( )
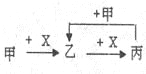
A.甲:C、X:O2
B.甲:NaOH溶液、X:CO2溶液
C.甲:Na、X:O2
D.甲:AlCl3溶液、X:NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图装置制得氯气并与铝粉反应制备无水AlCl3。已知AlCl3在183°C升华,遇潮湿空气即反应产生大量白雾。请回答问题:
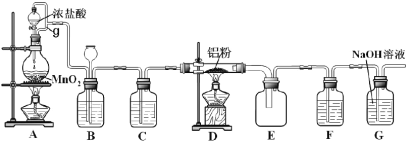
(1)A中反应的化学方程式为_________;HCl在反应中表现出的性质为______(填:酸性、氧化性或还原性)。
(2)A中g管的作用是________。
(3)B中盛放饱和食盐水的作用是________;若D中生成的AlCl3凝华堵塞导管,B中可观察到的现象为________。
(4)C和F所装试剂相同,其中F的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烃的分子式为C5H12,符合该分子式的同分异构体有3种,其中一卤代物有一种结构,此烃的结构简式为:_________________ .用系统法命名: ________________.
Ⅱ.已知乳酸的结构简式为 ![]() .试回答:
.试回答:
(1)乳酸分子中含有_____________和____________两种官能团(写名称);
(2)乳酸与金属钠溶液反应的化学方程式______________________________
(3)乳酸与Na2CO3溶液反应的化学方程式为_______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com