
分析 A、B、C、D、E、F、G、H八种元素位于元素周期表前四个周期,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同,符合条件的外围电子排布应为1s1、2s22p2、2s22p4、3s23p3,3d64s2,符合条件的元素有H、C、O、P、Fe.D的单质是中学化学常见的两性金属,D应为Al元素;D、H、F位于同一周期,即位于第三周期,可推知H为P元素;F原子的最外电子层的p电子数是s电子数的两倍,最外层电子排布为3s23p4,故F为S元素;A、B、C是三种非金属元素,且A、B、C能形成离子化合物,说明该化合物为铵盐,B与H位于同一主族,则B为N元素,而A与B的原子的核外电子数之和与C原子的核外电子数相等,则A为H元素,C为O元素;E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,则E为Fe元素,则E的价电子为8,则G的价电子数为4,可推知G为碳元素,据此解答.
解答 解:A、B、C、D、E、F、G、H八种元素位于元素周期表前四个周期,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同,符合条件的外围电子排布应为1s1、2s22p2、2s22p4、3s23p3,3d64s2,符合条件的元素有H、C、O、P、Fe.D的单质是中学化学常见的两性金属,D应为Al元素;D、H、F位于同一周期,即位于第三周期,可推知H为P元素;F原子的最外电子层的p电子数是s电子数的两倍,最外层电子排布为3s23p4,故F为S元素;A、B、C是三种非金属元素,且A、B、C能形成离子化合物,说明该化合物为铵盐,B与H位于同一主族,则B为N元素,而A与B的原子的核外电子数之和与C原子的核外电子数相等,则A为H元素,C为O元素;E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,则E为Fe元素,则E的价电子为8,则G的价电子数为4,可推知G为碳元素,所以A为H,B为N,C为O,D为Al,E为Fe,F为S,G为C,H为P.
(1)A、B、C形成的化合物为NH4NO3,属于离子化合物,含有离子键和共价键;Fe在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,则该化合物为硝酸,过量的Fe和稀硝酸反应生成硝酸亚铁和NO,反应的离子方程式为:3Fe+8H++2NO3-=3Fe2-+2NO↑+4H2O;Fe的基态原子的电子排布式为:1s22s22p63s23p63d64s2;Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6,Fe3+的价层电子为半充满状态,能量较低,故Fe3+较稳定,
故答案为:离子键、共价键;3Fe+8H++2NO3-=3Fe2-+2NO↑+4H2O;1s22s22p63s23p63d64s2;Fe3+>Fe2+;
(2)同主族元素从上到下,元素的第一电离能逐渐减小,同周期元素从左到右,元素的第一电离能逐渐增大,由于N的2p轨道为半充满状态,较稳定,所以N的第一电离能大于O,而O元素非金属性远强于P,故O元素第一电离能高于P,则第一电离能:N>O>P>Al,同主族元素从上到下,元素的电负性逐渐减小,同周期元素从左到右,元素的电负性逐渐增大,则电负性:Al<P<N<O,
故答案为:N>O>P>Al;Al<P<N<O;
(3)H、O、C可形成一种相对分子质量为46的一元羧酸分子,该羧酸为HCOOH,分子中含有4个σ键和1个π键,二者比值为4:1,由于S元素的非金属性大于C,形成的氢化物较稳定,所以S-H键键能较大,
故答案为:4:1;>;
(4)Al分别和盐酸、NaOH反应的化学方程式为2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,相同物质的量的盐酸和NaOH溶液分别与Al反应时,NaOH生成氢气多,为盐酸的3倍,Al3-和AlO2-能发生相互促进的水解反应生成Al(OH)3,反应的离子方程式为Al3-+3AlO2-+6H2O=4Al(OH)3↓,
故答案为:3:1;Al3-+3AlO2-+6H2O=4Al(OH)3↓;
(5)由H、O、S可形成两种酸类化合物分别为H2SO3、H2SO4,H2SO4酸性强于H2SO3,将亚硫酸钠溶液加入硫酸或亚硫酸氢钠溶液加入硫酸中分别发生:2H++SO32-=SO2↑+H2O或H++HSO3-=SO2↑+H2O,可证明H2SO4酸性强于H2SO3,由H、O、S与钠四种元素按原子个数比为l:3:1:1组成一种化合物为NaHSO3,其水溶液呈酸性,说明HSO3-电离程度大于水解程度,则溶液中存在c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:2H++SO32-=SO2↑+H2O或H++HSO3-=SO2↑+H2O;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查结构性质位置关系综合应用,题目比较综合,正确推断元素的种类为解答该题的关键,需要学生具备扎实的基础,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 聚四氟乙烯的化学活动性很强 | B. | 聚四氟乙烯分子中含有双键 | ||
| C. | 聚四氟乙烯的单体是不饱和烃 | D. | 聚四氟乙烯中氟的质量分数是76% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=$\frac{0.10}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50 s内B的平均反应速率v(B)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol•L-1,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2D与H2T互为同素异形体 | |
| B. | 不同元素的原子构成的分子只含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同、质子数相同的同种核素 | |
| D. | 短周期第 IVA与第 VIIA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处在同一直线上 | |
| B. | 它的五氯代物数目与三氯代物的数目相等 | |
| C. | 它属于烃类 | |
| D. | 该物质易溶于水,难溶于有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度、体积不变,充入氩气 | B. | 条件不变,对体系加热 | ||
| C. | 温度、体积不变,充入氯气 | D. | 温度不变,增大容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
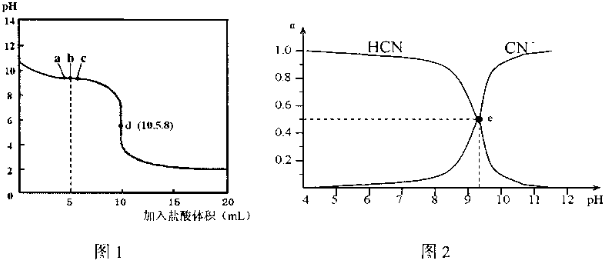
| A. | b点时,溶液中微粒浓度大小的关系:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) | |
| B. | d点溶液存在的关系:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-) | |
| C. | 图2中的e点对应图1中的c点 | |
| D. | 在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com