
【题目】关于NO2与水反应,( )
A.NO2只做氧化剂B.NO2只做还原剂
C.NO2既做氧化剂又做还原剂D.氮元素的化合价不发生变化
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( ) 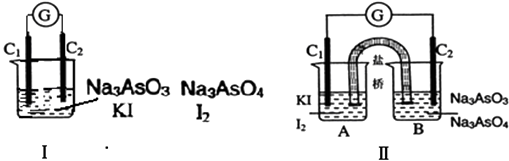
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2+2e﹣═2I﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置处理含NO3﹣的酸性工业废水,某电极反应式为2NO3﹣+12H++10e﹣=N2+6H2O,则下列说法错误的( ) 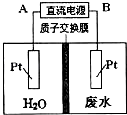
A.电源正极为A,电解过程中有气体放出
B.电解时H+从质子交换膜左侧向右侧移动
C.电解过程中,右侧电解液pH保持不变
D.电解池一侧生成5.6g N2 , 另一侧溶液质量减少l8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用DHP作保护基合成梨小食心虫性外激素(H) 的路线如下:

己知:①DHP(![]() ) 的保护和脱保护机理为
) 的保护和脱保护机理为
②R-C≡CNa+R1Br→R-C≡C-R1+NaBr
③R-C≡CNa+ R1OH→R-C≡CH+R1ONa
(1)A的化学名称为________。
(2)F-G的反应类型________;G-H 的反应类型________。
(3)F的结构简式为_________ 。
(4)写出C→E 的化学方程式________ 。
(5)DHP的同分异构体中,能同时满足下列条件的共有______种(不考虑立体异构)
①链状结构 ②能发生银镜反应 ③分子中只有一个甲基。
写出其中核磁共振氢谱显示4组峰,且峰面积之比为3 :2:2: 1的所有分子结构简式:_______。
(6)写出用 和CH3C≡CNa 制备
和CH3C≡CNa 制备 的合成路线(其它试剂任选) ____。
的合成路线(其它试剂任选) ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RNA 水解后,得到的化学物质是
A .氨基酸、葡萄糖、碱基
B .氨基酸、核糖、核苷酸
C .核糖、碱基、磷酸
D .脱氧核糖、碱基、磷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,![]() 与R-发生如下反应
与R-发生如下反应![]() +5R-+6H+=3R2+3H2O,下列有关R元素的叙述正确的是( )
+5R-+6H+=3R2+3H2O,下列有关R元素的叙述正确的是( )
A. R是第ⅤA族元素 B. R2在常温下一定是气体
C. ![]() 中的R元素只能被还原 D. R的氢化物的水溶液是强酸
中的R元素只能被还原 D. R的氢化物的水溶液是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____kJ·mol-1。
(2)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。

①M点时,H2的转化率为____;压强:p1____(填“>”“<”或“=”)p2。
②反应速率:N点v正(CO)____(填“>”“<”或“=”)M点v逆(CO)。
③若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图2所示。则温度为506 K时,平衡常数K=____(保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____。
④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________。
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。

回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素e的负一价离子的结构示意图为________,与元素g的简单离子,二者的离子半径大小顺序为________。(用离子符号表示)
(3)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(4)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究 Na2S 溶液与 KMnO4 溶液反应,探究过程如下。

资料:Ⅰ.MnO4 在强酸性条件下被还原为 Mn2+,在近中性条件下被还原为 MnO2.
Ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S 具有________性。
(2)甲同学预测实验I中S2-被氧化成 SO32-。
①根据实验现象,乙同学认为甲的预测不合理,理由是_______________。
②乙同学取实验Ⅰ中少量溶液进行实验,检测到有 SO42-,得出 S2-被氧化成 SO42-的结论,丙同学否定该结论,理由是_______________。
③同学们经讨论后,设计了如右下图的实验,证实该条件下 MnO4-的确可以将 S2-氧化成SO42-。
a.左侧烧杯中的溶液是__________。
b.连通后电流计指针偏转,一段时间后,_________(填操作和现象),证明S2-被氧化为SO42-。
(3)实验 I 的现象与资料 i 存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(MnO4-)发生反应,该反应的离子方程式是______________。
(4)实验Ⅱ的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案_______。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与__________因素有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com