
| A. | 锡中加入一定量的铅制成焊锡,目的使被焊接的部分更牢固,更不易被氧化 | |
| B. | 聚乙烯制成塑料薄膜,用于食品、药品包装的材料 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
分析 A.合金的熔点低于组成它的成分合金;
B.聚乙烯无毒,可以用于包装食品;
C.大量燃烧化石燃料可产生有害气体和烟尘;
D.重金属离子对人体有毒,不能随意排放.
解答 解:A.锡中加入一定量的铅制成焊锡是锡和铅的混合物,属于合金,合金的熔点低于组成它的成分合金,能达到降低熔点的目的,故A错误;
B.聚乙烯无毒,用于食品、药品包装材料,故B正确;
C.大量燃烧化石燃料可产生有害气体和烟尘,是造成雾霾天气的一种重要因素,故C正确;
D.含重金属离子的电镀液随意排放会引起环境污染,故D正确.
故选A.
点评 本题考查了环境污染与治理,熟悉物质的性质是解题关键,注意对常见环境污染及治理知识的积累,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇难溶于水 | B. | 乙烯可使酸性KMnO4溶液褪色 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 苯不能萃取碘水中的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述条件下,SO2可能100%的转化为SO3 | |
| B. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2与SO3的浓度保持不变 | |
| D. | 为了提高SO2的转化率,可以适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
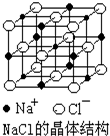 NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )
NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )| A. | $\frac{0.585}{4{a}^{3}ρ}$ | B. | $\frac{5.85}{8{a}^{3}ρ}$ | C. | $\frac{58.5}{2{a}^{3}ρ}$ | D. | $\frac{58.5}{{a}^{3}ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.
=$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com