
(1)现有1mol/L CaCl2溶液0.5L,Cl﹣的物质的量浓度为 mol/L.
(2)标准状况下,33.6L的HCl所具有的物质的量为 mol,将其溶解于水配成3L的溶液,所得盐酸的物质的量浓度为 mol/L.
(3)8gNaOH溶于 g水中,才能使每10个水分子中溶有一个钠离子.
考点:
物质的量的相关计算.
专题:
计算题.
分析:
(1)氯化钙中钙离子浓度与氯化钙浓度之比为2:1;
(2)n=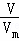 ,C=
,C=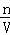 ;
;
(3)n(NaOH)=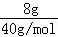 =0.2mol,要使每10个水分子中溶有一个钠离子,则水的物质的量与氢氧化钠的物质的量之比为10:1,再根据m=nM计算水的质量.
=0.2mol,要使每10个水分子中溶有一个钠离子,则水的物质的量与氢氧化钠的物质的量之比为10:1,再根据m=nM计算水的质量.
解答:
解:(1)氯化钙中钙离子浓度与氯化钙浓度之比为2:1,氯化钙的浓度是1mol/L,则氯离子的浓度是2mol/L,故答案为:2;
(2)n=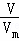 =
= =1.5mol,C=
=1.5mol,C= =
=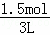 =0.5mol/L,
=0.5mol/L,
故答案为:1.5;0.5;
(3)n(NaOH)=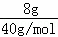 =0.2mol,要使每10个水分子中溶有一个钠离子,则水的物质的量与氢氧化钠的物质的量之比为10:1,再根据m=nM计算水的质量.
=0.2mol,要使每10个水分子中溶有一个钠离子,则水的物质的量与氢氧化钠的物质的量之比为10:1,再根据m=nM计算水的质量.
n(NaOH)=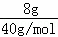 =0.2mol,要使每10个水分子中溶有一个钠离子,则水的物质的量与氢氧化钠的物质的量之比为10:1,
=0.2mol,要使每10个水分子中溶有一个钠离子,则水的物质的量与氢氧化钠的物质的量之比为10:1,
水的质量m=nM=0.2mol×10×18g/mol=36g,
故答案为:36.
点评:
本题考查了物质的量的计算,根据基本公式中各个物理量的关系进行计算,注意(1)中化合物与化合物中各种元素之间的关系,为易错点.


科目:高中化学 来源: 题型:
三草酸合铁酸钾(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL 于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4﹣同时被还原为Mn2+.向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+.
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL.
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、冷却、转移、洗涤并转移、 、摇匀.
(2)加入锌粉的目的是 .
(3)写出步骤三中发生反应的离子方程式 .
(4)实验测得该晶体中铁的质量分数为 .在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.
(5)请纠正上述实验过程中的两处错误: .
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)147gH2SO4中含 mol原子,与 g CO2所含有的氧原子数相同.
标准状况下,2.4g某气体的体积为672mL,则此气体的相对分子质量为 .
(3)在标准状况下,V L氨气溶于1L水中,所得溶液的密度为ρg•cm﹣3,溶液的质量分数为ω.则此溶液的物质的量浓度为: 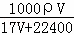 或
或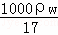 mol/L
mol/L
(4)将Wg胆矾(CuSO4 •5H2O )溶解在VmL水中,得到饱和溶液,测得该饱和溶液的密度为ρg/cm3,则溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl﹣物质的量浓度相等的是( )
|
| A. | 150mL 2mol/L KCl溶液 | B. | 75mL 1.5mol/L MgCl2溶液 |
|
| C. | 100mL 1mol/L NaCl溶液 | D. | 25mL 2mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是( )
|
| A. | 应使混合物中的水分完全蒸干后,才能停止加热 |
|
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
|
| C. | 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中 |
|
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 标准状况下任何气体的摩尔体积都是22.4 L |
|
| B. | 1mol气体的体积若是22.4 L,它必定处于标准状况 |
|
| C. | 两种气体的物质的量之比等于其原子个数比 |
|
| D. | 标准状况下,1mol H2和O2的混合气体的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有1mol/L CaCl2溶液0.5L,Cl﹣的物质的量浓度为 mol/L.
(2)标准状况下,33.6L的HCl所具有的物质的量为 mol,将其溶解于水配成3L的溶液,所得盐酸的物质的量浓度为 mol/L.
(3)8gNaOH溶于 g水中,才能使每10个水分子中溶有一个钠离子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com