
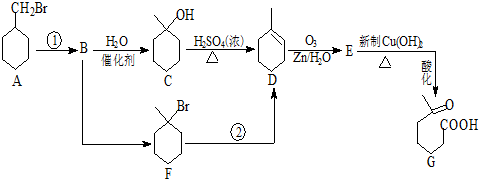
 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O.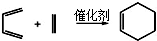
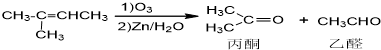
 )也可以发生“Diels-Alder反应”,该化学方程式为:
)也可以发生“Diels-Alder反应”,该化学方程式为: 分析 由合成流程图可知,A→B为消去反应,B为CH2= ,B→C为与水的加成反应,C→D为消去反应,结合信息可知,D→E发生氧化反应,且E与新制Cu(OH)2反应,则E为
,B→C为与水的加成反应,C→D为消去反应,结合信息可知,D→E发生氧化反应,且E与新制Cu(OH)2反应,则E为 ,E→G发生氧化反应,B→F为与HBr发生的加成反应,F→D为卤代烃的消去反应,然后结合有机物的结构和性质来解答.
,E→G发生氧化反应,B→F为与HBr发生的加成反应,F→D为卤代烃的消去反应,然后结合有机物的结构和性质来解答.
解答 解:由合成流程图可知,A→B为消去反应,B为CH2= ,B→C为与水的加成反应,C→D为消去反应,结合信息可知,D→E发生氧化反应,且E与新制Cu(OH)2反应,则E为
,B→C为与水的加成反应,C→D为消去反应,结合信息可知,D→E发生氧化反应,且E与新制Cu(OH)2反应,则E为 ,E→G发生氧化反应,B→F为与HBr发生的加成反应,F→D为卤代烃的消去反应,
,E→G发生氧化反应,B→F为与HBr发生的加成反应,F→D为卤代烃的消去反应,
(1)由上述分析可知C→D的反应类型是消去反应,
故答案为:消去反应;
(2)a.因C中与-OH相连的碳原子上没有H,则C不能被催化氧化成酮,故a错误;
b.D中有碳碳双键,能使酸性高锰酸钾溶液褪色,故b错误;
c.E为 ,Ni催化下1mol E最多可与2molH2加成,故c正确;
,Ni催化下1mol E最多可与2molH2加成,故c正确;
d.G有羰基能发生加成反应,有羧基能发生取代反应,故d正确;
故选cd;
(3)E与新制Cu(OH)2的化学方程式为为 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O,
+Cu2O↓+3H2O,
故答案为: +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2OO;
+Cu2O↓+3H2OO;
(4)根据条件A.分子中含有环己烷的结构,说明有一个六元环,B.能与NaHCO3溶液反应,放出气体,说明有羧基,C.1mol该物质能与2molNa完全反应,说明有两个-OH,则符合条件的G的结构为六元碳环上连有一个羧基和一个羟基,有四种结构,
故答案为:4;
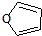
(5)由信息可知,物质D与呋喃的反应为 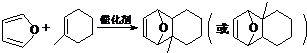 ,
,
故答案为: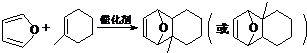 .
.
点评 本题考查有机物的合成,注意利用合成流程图中物质的结构及官能团的变化来分析发生的反应及物质的性质,同分异构体的书写为解答的难点,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题
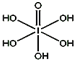 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>③>①>② | B. | ④>③>②>① | C. | ②>③>④>① | D. | ②>④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
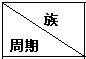 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑩ | |||||
| 三 | ① | ③ | ⑤ | ④ | ⑧ | ⑪ | ||
| 四 | ② | ⑨ |
 ,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)
,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和食盐水滴入盛有电石的烧瓶中制乙炔 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 用乙醇与3mol•L-1的H2SO4混合共热到170℃以上制乙烯 | |
| D. | 向氯仿中加入NaOH溶液,加热充分反应后,再加入AgNO3溶液,若观察到白色沉淀即可证明氯仿中含有氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极和负极必须是两种不同的金属 | |
| B. | 电子流入的一极为正极 | |
| C. | 原电池工作时,正极和负极上发生的都是氧化还原反应 | |
| D. | 锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com