
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

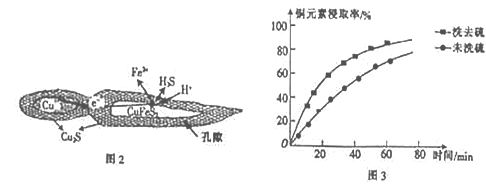
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________________。
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为______;浸取时,在有氧环境下可维持Fe2+较高浓度,有关反应的离子方程式为________。
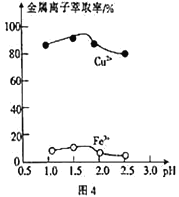
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3 所示,未洗硫时铜元素浸取率较低,其原因是_____________________。
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4 所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe2+萃取率降低的原因是_________________。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_______________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_____等操作可得到Fe2O3产品。
【答案】 CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑ 2mol 4Fe2++O2+4H+=4Fe3++2H2O 生成的硫覆盖在Cu2S表面,阻碍浸取 Fe3+水解程度随pH的升高而增大 32:7 洗涤 煅烧(或灼烧)
【解析】(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,根据图示,同时生成了Fe2+和H2S,反应的离子方程式为CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑,故答案为:CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑;
(2)①根据反应: Cu2S+4FeCl3=2CuCl2+4FeCl2+S,反应中S元素由-2价升高为0价,Cu元素由+1价升高为+2价,铁元素由+3价降低为+2价,转移4个电子,则每生成1molCuCl2,反应中转移电子2mol;浸取时,在有氧环境下可维持Fe3+较高浓度,是因为氧气能够氧化亚铁离子,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,故答案为:2mol;4Fe2++O2+4H+=4Fe3++2H2O;
②浸取过程中加入洗涤剂溶解硫时,如果未洗硫,生成的硫覆盖在Cu2S表面,阻碍浸取,会使铜元素浸取率较低,故答案为:生成的硫覆盖在Cu2S表面,阻碍浸取;
(3)Fe3+的水解程度随着pH的升高而增大,萃取率越低;故答案为:Fe3+的水解程度随着pH的升高而增大;
(4)在碱性条件下,Cu2+与N2H4反应生成氮气和铜,反应为:2Cu2++N2H4+4OH-=2Cu+N2↑+4H2O,反应中铜元素化合价降低被还原,铜为还原产物,N元素化合价升高被氧化,氮气为氧化产物,还原产物与氧化产物的质量之比![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(5)萃取后的“水相”中含有铁离子,加入氨水,反应生成氢氧化铁沉淀,煅烧可得到,方法为:在萃取后的“水相”中加入适量氨水,静置,过滤,洗涤,干燥,煅烧可得到Fe2O3产品,故答案为:洗涤;煅烧。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法不正确的是( )
A. 若①是某种大分子的基本组成单位,则①是氨基酸
B. 若②是生命活动的主要能源物质,则②是糖类
C. 若②是细胞中的储能物质,则②一定是脂肪
D. 若③是携带遗传信息的大分子物质,则③一定是核酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。则相同条件下破坏1molNO中化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=____ kJ·mol-1;若加入少量NaOH固体,则溶液中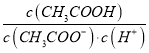 _____(填“增大”、“减小”或“不变”)。
_____(填“增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
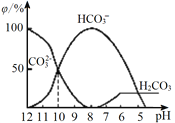
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______。
HCO3-+OH-的平衡常数Kh=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应中能量变化的说法正确的是
A.断开化学键会释放能量B.氧化还原反应均为放热反应
C.化学反应过程中一定伴有能量变化D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________ L,V(H2)=________ L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________。
(3)若剩余气体的体积为a L,则a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有1 mol HNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是

A. b表示Fe3+物质的量的变化线
B. n1=0.8
C. P点时,n(Fe2+)=0.45mol
D. 加入的铁为n3mol时,再向溶液中加入铜粉,铜粉可以溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,关于该有机物的说法不正确的是( )
,关于该有机物的说法不正确的是( )
A. 1 mol该有机物能与2 mol NaOH发生反应
B. 1 mol该有机物能与2 mol Na反应生成1 mol H2
C. 1 mol该有机物能与1 mol NaHCO3反应生成1 mol CO2
D. 1 mol该有机物最多能与4 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融)![]() 2Na+Cl2↑。已知物质A、B、C、D、E、F有如图所示转化关系:
2Na+Cl2↑。已知物质A、B、C、D、E、F有如图所示转化关系:

请按要求书写:
(1)A→C的化学方程式:_______________________________________________________。
(2)B→D的化学方程式:___________________________________________________________。
(3)E+F→NaCl的化学方程式:____________________________________________。
(4)过氧化钠可用作制氧剂,写出过氧化钠与二氧化碳反应的化学方程式:______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com