
| A. | 在相同条件下,甲酸的导电性比强酸溶液的导电性弱 | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
分析 A、溶液的导电性取决于自由移动离子浓度和自由移动离子带电数目;
B、甲酸与水以任意比例互溶,这是甲酸的物理性质,不能证明是弱电解质;
C、是中和反应,按照反应方程式进行;
D、甲酸是弱电解质,不能完全电离.
解答 解:A、溶液的导电性取决于自由移动离子浓度和自由移动离子带电数目,与电解质的强弱无关,故A错误;
B.甲酸水溶性是物理性质,不能证明是弱电解质,故B错误;
C.根据方程式可知不论酸碱强弱,只有一元酸与一元碱物质的量相等则恰好发生酸碱中和,完全反应,故C错误;
D、1mol•L-1的甲酸溶液的c(H+)约为0.01mol•L-1说明甲酸不能完全电离,可以证明是弱电解质,故D正确;
故选D.
点评 本题考查了弱电解质的判断,题目难度不大,注意把握住弱电解质的定义“部分电离”的特点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
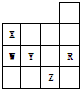
| A. | 常压下五种元素的单质中Z单质的沸点最高 | |
| B. | X和W的常见单质的分子式分别为X2和W2 | |
| C. | W的氢化物沸点比X的氢化物的沸点低 | |
| D. | R最高氧化物水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用焰色反应可鉴别K2CO3溶液和Na2CO3溶液 | |
| B. | 利用丁达尔效应可鉴别溶液和胶体 | |
| C. | 运用蒸馏的方法,可以分离沸点相差较大的液体混合物 | |
| D. | 广范pH试纸测得某碱性溶液的pH为12.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量CH3COONa固体 | B. | 加水 | ||
| C. | 加少量CuSO4固体 | D. | 加等量等浓度Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | F- | D. | Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com