
| A.干冰升华要吸收大量的热,这就是化学反应中的吸热反应 |
| B.酒精常被用作酒精灯和内燃机中的燃料,说明酒精燃烧是放热反应 |
| C.木炭常温下不燃烧,加热才能燃烧,但木炭燃烧是放热反应 |
| D.人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 |
科目:高中化学 来源:不详 题型:实验题
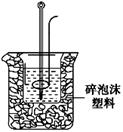
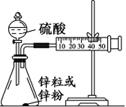
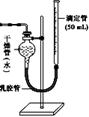
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增大反应物的浓度,活化分子百分数增加,反应速率加快? |
| B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快 |
| C.升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大 |
| D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.相同条件下,导电性强的溶液比导电性弱的溶液中自由移动离子数目多 |
| B.由C(石墨)→C(金刚石)△H= +11.9kJ·mol—1可知,金刚石比石墨稳定 |
| C.在AgNO3溶液中加入过量的稀盐酸后,溶液中不存在Ag+ |
| D.任何一个化学变化都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
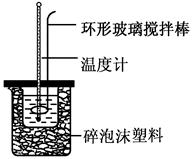
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.需要加热才能发生的反应一定是吸热反应 |
| B.反应4Fe(OH)2(s) +02(g)+2H20(l)=4Fe(OH)3(S)的△H>O |
C.已知①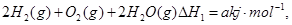 ② 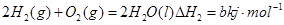 ,则a<b ,则a<b |
| D.CO(g)的标准燃烧是283.0kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)△H=+566.0kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
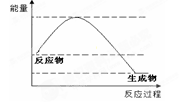
| A.该反应的反应热△H < 0 |
| B.反应物的总能量低于生成物的总能量 |
| C.该反应是吸热反应 |
| D.加入催化剂后反应放出的热会减少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol |
| C.温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 |
| D.酸与碱恰好完全反应生成正盐的c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com