

| A. | 阳极产生KOH | |
| B. | 阴极产生KOH | |
| C. | 大量H+ 通过离子交换膜从左侧到右侧 | |
| D. | 大量K+通过离子交换膜从右侧到左侧 |
分析 用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,故电解时,阳极:4OH--4e-=2H2O+O2↑,阴极:4H++4e-=2H2↑,其中阴极区H+放电,H+浓度减小,使水的电离平衡向右移动促进水的电离,OH-浓度增大.在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液.
解答 解:A.电解除杂过程相当于电解水,阳极反应式为:4OH--4e-=2H2O+O2↑,氢氧根离子浓度减小,不会获得KOH,故A错误;
B.电解时,阴极电极反应式为:4H++4e-=2H2↑,氢离子浓度减小,溶液的氢氧根离子浓度增大,钾离子移向该极,阴极产生KOH,故B正确;
C.电解质中的阳离子移向阴极,所以溶液中的H+通过离子交换膜从左侧到右侧,故C正确;
D.阳离子移向阴极,所以大量K+通过离子交换膜从左侧到右侧,故D错误;
故选BC.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,再结合离子移动方向确定产物,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离常数 | 1.8×10-5 | 2.9×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液①C(CH3COONa) ②C(NaClO) ③C(NaHCO3) ④C(Na2CO3)pH关系为:④>②>③>① | |
| B. | 少量CO2通入次氯酸钠溶液中:CO2+ClO-+H2O═HClO+HCO3- | |
| C. | 新制氯水中Cl2+H2O?HCl+HClO为适当增大HClO 的浓度,可加入少量固体Na2CO3 | |
| D. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
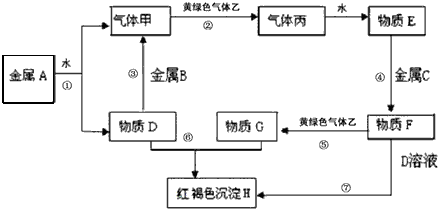
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物(括号内为杂质) | 除杂试剂(填序号) | 反 应 离 子 方 程 式 |
| ①Cu (CuO) | ||
| ②NaBr (NaI) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化 | |
| B. | 太阳能、煤气、潮汐能是一次能源:电力、蒸汽、地热是二次能源 | |
| C. | 吸热反应就是反应物的总能量比生成物的总能量小的反应:也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少的反应 | |
| D. | CO(g)的燃烧热是283.0kJ/mol则2CO2(g)=2CO(g)+O2(g) 反应的△H=+566.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ①③④⑥ | D. | ②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.448L | B. | 0.672L | C. | 0.896L | D. | 1.344L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制乙烯:浓硫酸、乙醇,用酒精灯迅速加热至170℃ | |
| B. | 制硝基苯:浓硝酸、浓硫酸、苯,用55~60℃水浴加热 | |
| C. | 制乙酸乙酯:乙醇、浓硫酸、冰醋酸,用酒精灯缓慢加热 | |
| D. | 制酚醛树脂:苯酚、40%的甲醛溶液、浓盐酸,用沸水浴加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com