
| A. | O2与O3 | B. | 12C与14C | C. | 甲烷与氯乙烷 | D. | 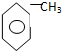 与 与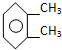 |
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然伴随能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键的断裂和形成引起的 | |
| C. | 凡是熵增大的反应都是自发反应 | |
| D. | 要判断反应进行的方向,必须综合考虑体系的焓变和熵变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
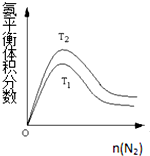
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g水中所含的电子数为10NA | |
| B. | 在标准状况下,1mol水的体积约为22.4L | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 11.2L氮气中含NA个氮原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液漏斗使用前要检查它是否漏水 | |
| B. | 萃取剂要求不溶于水,且比水更容易使碘溶解 | |
| C. | 分液时,下层液体应从下口流出,上层液体应从上口倒出 | |
| D. | 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后,不必静置,应立即分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和浓硫酸加热到140℃制取乙烯 | |
| B. | 乙烷和氯气光照下制取纯净的氯乙烷 | |
| C. | 在苯和溴水的混合物中加入铁粉制取溴苯 | |
| D. | 用酸性高锰酸钾溶液区分 和 和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为92 | B. | 中子数为235 | C. | 核外电子数为143 | D. | 质量数为92 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com