
| A. | 2Fe3++Fe═3Fe2+成立,说明氧化性:Fe3+>Fe2+ | |
| B. | SO2饱和溶液中NH4+、K+、CO32-、SO32-可大量存在 | |
| C. | 用NaOH溶液吸收尾气中的氯气:Cl2+4OH-═2ClO-+2H2O | |
| D. | 向NaHS溶液中加入适量硝酸发生反应:HS-+H+═H2S↑ |
分析 A.氧化剂的氧化性大于氧化产物的氧化性;
B.SO2与CO32-、SO32-均反应;
C.反应生成氯化钠、次氯酸钠和水;
D.发生氧化还原反应生成S、NO和水.
解答 解:A.2Fe3++Fe═3Fe2+成立,由氧化剂的氧化性大于氧化产物的氧化性说明氧化性:Fe3+>Fe2+,故A正确;
B.SO2与CO32-、SO32-均反应,不能大量共存,故B错误;
C.用NaOH溶液吸收尾气中的氯气的离子反应为Cl2+2OH-═ClO-+Cl-+H2O,故C错误;
D.向NaHS溶液中加入适量硝酸发生反应的离子反应为6HS-+4NO3-+10H+=6S↓+4NO↑+8H2O,故D错误;
故选A.
点评 本题考查离子的共存、离子反应方程式及氧化还原反应,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存及反应考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=6的盐酸用水稀释100倍 | |
| B. | pH=10的氨水用水稀释100倍 | |
| C. | pH=10的氢氧化钠溶液稀释1000倍 | |
| D. | 0.1 mol•L-1的硫酸100 mL跟0.2 mol•L-1 NaOH溶液100 mL完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 分离方法 | 原理 |
| A | 除去CO2中的HCl | 通入饱和Na2CO3溶液 | HCl和Na2CO3溶液反应生成CO2 |
| B | 除去乙醇中少量的乙酸 | 加入足量生石灰蒸馏 | 乙醇和乙酸钙的沸点相差较大 |
| C | 除去KNO3固体中NaCl | 冷却热饱和溶液重结晶 | NaCl在水中的溶解度很大 |
| D | 分离乙酸和乙醇 | 用分液漏斗分液 | 乙醇乙酯和乙醇的密度不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
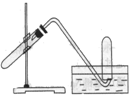
| A. | 加热NaHCO3制取和收集CO2 | |
| B. | 用铜和稀硝酸反应制取和收集NO | |
| C. | 用NH4Cl与浓NaOH溶液反应制取和收集NH3 | |
| D. | 用铜和浓硝酸反应制取和收集NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的纯水中,c(OH-)=10-8 mol•L-1 | |
| B. | 向0.1 mol•L-1Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液pH>7 | |
| D. | 0.1 mol•L-1Na2CO3溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浅黄色固体 | B. | 应密封保存 | ||
| C. | 与CO2反应时,CO2作还原剂 | D. | 与H2O反应时,放出大量的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
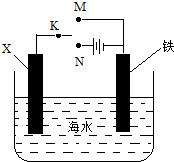
| A. | 若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 | |
| B. | 若X为碳棒,开关K置于M处,会加快铁的腐蚀 | |
| C. | 若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-═Fe${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com