
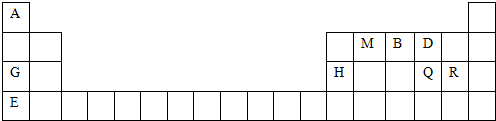
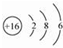
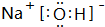 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程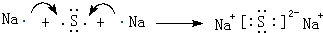 ;
;分析 根据元素在周期表中的位置,可知A是H,M是C,B是N,D是O,G是Na,H是Al,Q是S,R是Cl,E是K.
(1)由Q位置可知其位于第三周期ⅥA族;原子核外有16个电子,有3个电子层,各层电子数为2、8、6;
(2)电子层结构相同,核电荷数越大离子半径越小;
(3)C、O两元素形成的化合物有CO、CO2,原子之间均形成共价键,二氧化碳中碳和氧原子间形成2对共用电子对;
(4)NaOH由钠离子与氢氧根离子构成;G与Q形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成;
(5)利用单质之间的相互置换反应进行验证,如氯气与硫化钠反应生成硫与NaCl,可以证明Cl的非金属性强于硫;
(6)氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水.
解答 解:根据元素在周期表中的位置,可知A是H,M是C,B是N,D是O,G是Na,H是Al,Q是S,R是Cl,E是K.
(1)由Q位置可知其位于第三周期ⅥA族;原子核外有16个电子,有3个电子层,各层电子数为2、8、6,原子结构示意图为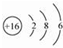 ,
,
故答案为:第三周期ⅥA族;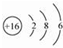 ;
;
(2)电子层结构相同,核电荷数越大离子半径越小,故离子半径:S2->Cl->K+,故答案为:S2->Cl->K+;
(3)C、O两元素形成的化合物有CO、CO2,原子之间均形成共价键,二氧化碳中碳和氧原子间形成2对共用电子对,结构式为:O=C=O,故答案为:共价键;O=C=O;
(4)NaOH由钠离子与氢氧根离子构成,电子式为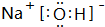 ;G与Q形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成为:
;G与Q形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成为: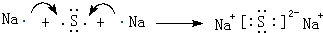 ,故答案为:
,故答案为: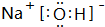 ;
;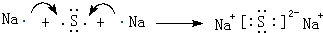 ;
;
(5)氯气与硫化钠反应生成硫与NaCl,可以证明Cl的非金属性强于硫,反应方程式为:Na2S+C12=2NaC1+S↓;故答案为:Na2S+C12=2NaC1+S↓;
(6)Y的氧化物为Al2O3,与NaOH溶液反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O.
点评 本题考查元素周期表与元素周期律,难度不大,关键是要在有一个完整准确的元素周期表判断元素,(5)中用化学方程式说明非金属性强弱为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
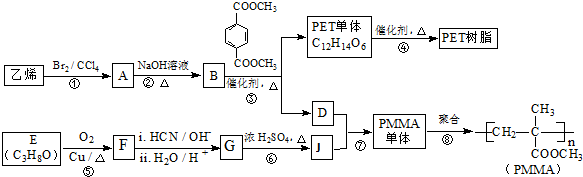 已知:
已知: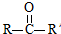 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$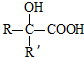 (R、R’代表烃基)
(R、R’代表烃基)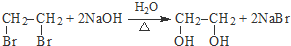 .
.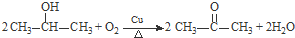 .
.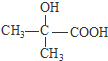 .
.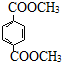 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: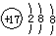 | |
| B. | N2的电子式: | |
| C. | CH4分子的比例模型: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、Cl-、SCN- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Al3+、Na+、Cl-、NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
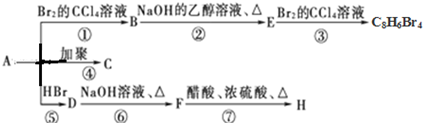
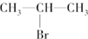 (主要产物)
(主要产物)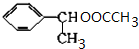 ,
,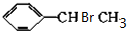 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$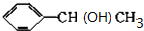 +NaBr.
+NaBr.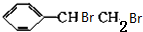 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$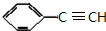 +2NaBr+2H2O
+2NaBr+2H2O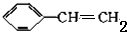 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
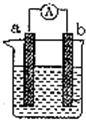 如图是某兴趣小组探究不同条件下化学能转变为电能的装置
如图是某兴趣小组探究不同条件下化学能转变为电能的装置查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com