
£Ø8·Ö£©½«Ļ”ĻõĖįÖšµĪ¼ÓČėŹ¢ÓŠĀĮĢśŗĻ½šµÄČŻĘ÷ÖŠ£¬µ±¹ĢĢåĒ”ŗĆĶźČ«ČܽāŹ±£¬²śÉś±ź×¼×“æöĻĀNO 40.32L£¬½«·“Ó¦ŗóµÄČÜŅŗĘ½¾ł·Ö³ÉČżµČ·Ż£¬·Ö±š½ųŠŠČēĻĀŹµŃé£ŗ
£Ø1£©µŚŅ»·ŻČÜŅŗÖŠÖšµĪ¼ÓČė2 mol”¤L-1NaOHČÜŅŗ£¬ÖĮĒ”ŗĆ“ļµ½×ī“ó³Įµķ£¬²»æ¼ĀĒæÕĘųÖŠO2µÄŃõ»Æ£¬ŌņŠč¼ÓČėNaOHČÜŅŗµÄĢå»żĪŖ________________”£
£Ø2£©µŚ¶ž·ŻČÜŅŗÖŠ±ß¼ÓČėNaOHČÜŅŗ£¬±ßŌŚæÕĘųÖŠ³ä·Ö½Į°č£¬ÖĮĒ”ŗĆ“ļµ½×ī“ó³ĮµķĮ棬½«²śÉśµÄ³Įµķ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ”¢³ĘĮæ±ČµŚŅ»·ŻÖŲ5.1g£¬ŌņøĆ¹ż³ĢÖŠĻūŗÄO2µÄĪļÖŹµÄĮæĪŖ_______________”£
£Ø3£©µŚČż·ŻČÜŅŗÖŠÖšµĪ¼ÓČė4 mol”¤L-1NaOHČÜŅŗ£¬ÖĮAl(OH)3³ĮµķĒ”ŗĆČܽā£¬ĻūŗÄNaOHČÜŅŗ500mL£¬¼ĘĖćŌŗĻ½šÖŠĀĮµÄÖŹĮ攣£ØŠ“³ö½āĢā¹ż³Ģ£©(4·Ö)
£Ø1£©900mL»ņ0.9L (2·Ö) £Ø2£©0.075mol(2·Ö)
£Ø3£©ŅĄ¾ŻNaŌ×ÓŹŲŗćÓŠ£ŗn(NaOH)=n(NaAlO2)+n(NaNO3)
n(NaOH)=4mol/L”Į0.5L”Į3=6mol (1·Ö)
ŅĄĢāŅāĻõĖį²»¹żĮæ,n(HNO3)=4n(NO)=4”Į(40.32L/22.4L/mol)=7.2mol
Ōņ£¬n(NaNO3)=3/4”Į7.2mol=5.4mol (1·Ö)
n(Al)= n(NaAlO2)=" n(NaOH)" £n(NaNO3)=6mol£5.4mol=0.6mol (1·Ö)
m(Al)=0.6mol”Į27g/mol=16.2g (1·Ö)
ŌŗĻ½šÖŠŗ¬ĀĮµÄÖŹĮæĪŖ16.2g £Ø“ĖĪŹČōѧɜĒó³ö5.4g£¬æɵĆ3·Ö£©
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©“ĖČŻĘ÷ÖŠ·¢Éś·“Ó¦Fe+4HNO3=Fe(NO3)3+NO+2H2O
Al+4HNO3=Al(NO3)3+NO+2H2O
Fe(NO3)3+3 NaOH= Fe(OH)3+3NaNO3
Al(NO3)3+3 NaOH= Al(OH)3+3NaNO3
»¹ÓŠæÉÄÜ·¢Éś£ŗFe+2 Fe(NO3)3= 3Fe(NO3)2
Fe(NO3)2+2NaOH= Fe(OH)2+2NaNO3
ŅĄĢāŅāĻõĖį²»¹żĮ棬Ćæ·ŻČÜŅŗÖŠn(HNO3)="4n(NO)" ”Į1/3="4”Į(40.32L/22.4L/mol)" 1/3
=2.4mol
ŅĄ¾ŻNŌŖĖŲŹŲŗć£ŗn(HNO3)= n(NaNO3)+ n(NO)
ÓÖn(NO)="40.32L/(22.4L/" mol) ”Į1/3="0.6" mol
n(NaNO3)="1.8" mol
¹Ź V£ØNaOH£©=" 1.8" mol/2 mol”¤L-1 = 0.9L
£Ø2£©µŚ¶ž·ŻČÜŅŗÖŠ¼ÓČėNaOHČÜŅŗµÄĶ¬Ź±ŌŚæÕĘųÖŠ³ä·Ö½Į°č£¬“ĖŹ±µÄFe(OH)2ĶźČ«×Ŗ»ÆĪŖFe(OH)3£¬·¢Éś·“Ó¦ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3£¬¹Ź³ĮµķŌöÖŲµÄÖŹĮæŹĒ4Fe(OH)2ĪüŹÕµÄŃõĘųŗĶĖ®µÄÖŹĮ棬¼“
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ”÷m
32 68
n(O2) ”Į32g/ mol 5.1g
n(O2)= 0.075mol
æ¼µć£ŗ±¾ĢāÖŠŅŌĀĮĢśÓėĻ”ĻõĖį·“Ó¦ĪŖŌŲĢ壬漲éĮĖŌŚ“Ė¹ż³ĢÖŠ·¢ÉśµÄ»Æѧ·“Ó¦£¬¼ĘĖćĢāÖŠ»Æѧ·½·ØµÄŌĖÓĆ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĀĮĶĮæóµÄÖ÷ŅŖ³É·ÖŹĒAl2O3”¢Fe2O3”¢SiO2µČ£¬“ÓĀĮĶĮæóŅ±Į¶Al2O3µÄĮ÷³ĢČēĻĀ£ŗ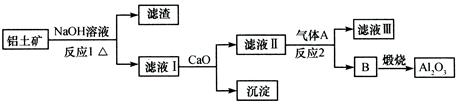
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
| A£®ĘųĢåAŅ»¶ØĪŖHCl | B£®ĀĖŅŗ¢ńÖŠČÜÖŹ½öŗ¬NaAlO2 |
| C£®³ĮµķµÄÖ÷ŅŖ³É·ÖĪŖ¹čĖįøĘ | D£®·“Ó¦1”¢·“Ó¦2¾ł²»ŹĒŃõ»Æ»¹Ō·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø9·Ö£©Ļõ·ÆŹÆµÄÖ÷ŅŖ³É·ÖŹĒK2SO4”¤Al2(SO4)3”¤2Al2O3”¤6H2O¼°ÉŁĮæŃõ»ÆĢś”£
ĄūÓĆĆ÷·ÆŹÆÖʱøK2SO4µÄ¹¤ŅÕĮ÷³ĢČēĻĀĖłŹ¾£ŗ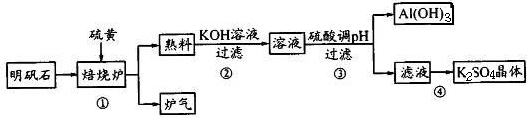
£Ø1£©±ŗÉÕĀÆÖŠ·¢ÉśČēĻĀ·“Ó¦£¬ĒėŌŚ·½³ĢŹ½ÖŠ±ķŹ¾³öµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ
2Al2(SO4)3£«3S 2Al2O3£«9SO2”ü
2Al2O3£«9SO2”ü
£Ø2£©²½Öč¢ŚÉę¼°Al2O3µÄĄė×Ó·½³ĢŹ½ĪŖ____”£
£Ø3£©²½Öč¢Ūµ÷pHÉś³ÉAI{OH)”£µÄĄė×Ó·½³ĢŹ½ĪŖ____£»²»ÄÜÓĆCO2Ą“µ÷pH£¬ĄķÓÉŹĒ
.
£Ø4£©²½Öč¢ÜµÄÖ÷ŅŖ²Ł×÷²½ÖčŹĒ___ _£¬¹żĀĖ”¢Ļ“µÓŗĶøÉŌļ
£Ø5£©ĀÆĘų»ŲŹÕæÉ×ö¶ąÖÖÓĆĶ¾£¬Ēė¾ŁŅ»Ąż£ŗ__ _”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
A.”¢B”¢C”¢D”¢E”¢FĮłÖÖĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø·“Ó¦Ģõ¼žŗĶ²æ·Ö²śĪļĪ“±ź³ö)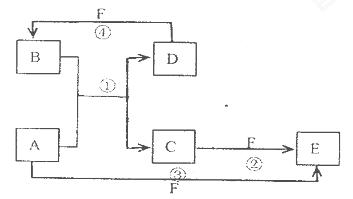
£Ø1£©ČōAĪŖ¶ĢÖÜĘŚ½šŹōµ„ÖŹ£¬DĪŖ¶ĢÖÜĘŚ·Ē½šŹōµ„ÖŹ£¬ĒŅĖłŗ¬ŌŖĖŲµÄŌ×ÓŠņŹżAŹĒDµÄ2±¶£¬Ėłŗ¬ŌŖĖŲµÄŌ×Ó×īĶā²ćµēÓ菿DŹĒAµÄ2±¶£¬FµÄÅØČÜŅŗÓėA D·“Ó¦¶¼ÓŠŗģ×ŲÉ«ĘųĢåÉś³É£¬ŌņAĪŖ___________________£¬
·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½ĪŖ____________________________________.
£Ø2£©ČōAĪŖ³£¼ūµÄ½šŹōµ„ÖŹ£¬D FŹĒĘųĢ¬µ„ÖŹ£¬·“Ó¦¢ŁŌŚĖ®ČÜŅŗÖŠ½ųŠŠ£¬Ōņ·“Ó¦¢Ś£ØŌŚĖ®ČÜŅŗÖŠ½ųŠŠ£©µÄĄė×Ó·½³ĢŹ½ŹĒ____________________________.
£Ø3£©ČōA£®D£®F¶¼ŹĒ¶ĢÖÜĘŚ·Ē½šŹōŌŖĖŲµ„ÖŹ£¬ĒŅA£®DĖłŗ¬ŌŖĖŲĶ¬Ö÷×壬A£®FĖłŗ¬ŌŖĖŲĶ¬ÖÜĘŚ£¬Ōņ·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ________________________.
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø16·Ö£©»ŌĶæóŹĒŅ±Į¶ĶµÄÖŲŅŖŌĮĻ”£
£Ø1£©¹¤ŅµÉĻŅ±Į¶“ÖĶµÄijÖÖ·“Ó¦ĪŖ£ŗCu2S+O2£½2Cu+SO2
¢Łµ±²śÉś±źæöĻĀ11.2LĘųĢåŹ±£¬×ŖŅʵē×ÓŹżÄæĪŖ £»
¢Ś½«“ÖĶ½ųŠŠµē½ā¾«Į¶£¬“ÖĶÓ¦ÓėĶāµēŌ“µÄ ¼«Ļą½Ó£»Čō¾«Į¶Ä³ÖÖ½öŗ¬ŌÓÖŹŠæµÄ“ÖĶ£¬ĶصēŅ»¶ĪŹ±¼äŗó²āµĆŅõ¼«ŌöÖŲag£¬µē½āÖŹČÜŅŗŌöÖŲbg£¬Ōņ“ÖĶÖŠŗ¬ŠæµÄÖŹĮæ·ÖŹżĪŖ £»
£Ø2£©½«»ŌĶæó”¢ČķĆĢæó×öČēĻĀ“¦Ąķ£¬æÉŅŌÖĘµĆ¼īŹ½Ģ¼ĖįĶ£ŗ
¢ŁĶµ„ÖŹ·ÅÖĆÓŚ³±ŹŖæÕĘųÖŠ£¬ČŻŅ×Éś³É¼īŹ½Ģ¼ĖįĶ£¬·“Ó¦»Æѧ·½³ĢŹ½ŹĒ £»
¢Ś²½Öč¢ņÖŠ£¬Ģ¼ĖįĒāļ§²ĪÓė·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £»
¢Ū²½Öč¢ńÖŠ·¢ÉśČēĻĀ3øö·“Ó¦£¬ŅŃÖŖ·“Ó¦i)ÖŠÉś³ÉµÄĮņĖįĢśĘš“ß»Æ×÷ÓĆ”£ĒėŠ“³ö·“Ó¦iii)µÄ»Æѧ·½³ĢŹ½”£
i)Fe2O3+3H2SO4 £½Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 £½CuSO4+CuS+2FeSO4
iii)
¢Ü²½Öč¢ņÖŠµ÷½ŚpHŗóµÄČÜŅŗÖŠ£¬ĶĄė×ÓÅضČ×ī“ó²»Äܳ¬¹ż mol/L”£
£ØŅŃÖŖKsp[(Cu(OH)2)]£½2”Į10£a£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ÄĘĮņµē³Ų×÷ĪŖŅ»ÖÖŠĀŠĶ“¢Äܵē³Ų£¬ĘäÓ¦ÓĆÖš½„µĆµ½ÖŲŹÓŗĶ·¢Õ¹”£
£Ø1£©Al(NO3)3ŹĒÖʱøÄĘĮņµē³Ų²æ¼žµÄŌĮĻÖ®Ņ»”£ÓÉÓŚAl(NO3)3ČŻŅ×ĪüŹÕ»·¾³ÖŠµÄĖ®·Ö£¬ŠčŅŖ¶ŌĘä½ųŠŠ¶ØĮæ·ÖĪö”£¾ßĢå²½ÖčČēĻĀĶ¼ĖłŹ¾£ŗ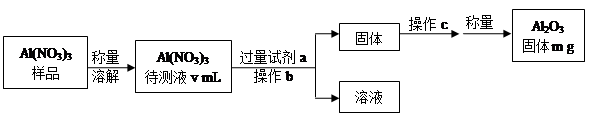
¢Ł¼ÓČėŹŌ¼Įaŗó·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
¢Ś²Ł×÷bĪŖ £¬²Ł×÷cĪŖ ”£
¢ŪAl(NO3)3“ż²āŅŗÖŠ£¬c (Al3+) = mol”¤L-1£ØÓĆm”¢v±ķŹ¾£©”£
£Ø2£©ÄĘĮņµē³ŲŅŌČŪČŚ½šŹōÄĘ”¢ČŪČŚĮņŗĶ¶ąĮņ»ÆÄĘ£ØNa2Sx£©·Ö±š×÷ĪŖĮ½øöµē¼«µÄ·“Ó¦Īļ£¬¹ĢĢåAl2O3ĢÕ“É£ØæÉ“«µ¼Na+£©ĪŖµē½āÖŹ£¬Ęä·“Ó¦ŌĄķČēĻĀĶ¼ĖłŹ¾£ŗ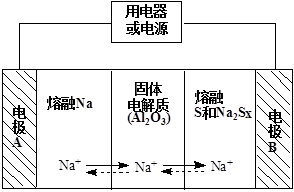
¢Łøł¾ŻĻĀ±ķŹż¾Ż£¬ĒėÄćÅŠ¶ĻøƵē³Ų¹¤×÷µÄŹŹŅĖĪĀ¶ČÓ¦æŲÖĘŌŚ ·¶Ī§ÄŚ£ØĢī×ÖÄøŠņŗÅ£©”£
| ĪļÖŹ | Na | S | Al2O3 |
| ČŪµć/”ę | 97£®8 | 115 | 2050 |
| ·Šµć/”ę | 892 | 444£®6 | 2980 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ć¾¼°ĘäŗĻ½šŹĒŅ»ÖÖÓĆĶ¾ŗܹćµÄ½šŹō²ÄĮĻ£¬ÄæĒ°ŹĄ½ēÉĻ60%µÄĆ¾ŹĒ“Óŗ£Ė®ÖŠĢįČ”µÄ”£Ä³Ń§Š£æĪĶāŠĖȤŠ”×é“Óŗ£Ė®É¹ŃĪŗóµÄŃĪĀ±(Ö÷ŅŖŗ¬Na£«”¢Mg2£«”¢Cl£”¢Br£µČ)ÖŠÄ£Äā¹¤ŅµÉś²śĄ“ĢįČ”Ć¾£¬Ö÷ŅŖ¹ż³ĢČēĻĀ£ŗ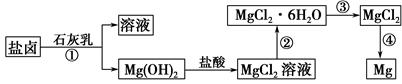
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)¹¤ŅµÉĻ“ÓŃĪĀ±ÖŠ»ńČ”Mg(OH)2ÓĆŹÆ»ŅČé¶ų²»ÓĆNaOHČÜŅŗµÄŌŅņŹĒ ”£
(2)“Ó¹ż³Ģ¢ŁµĆµ½µÄMg(OH)2³ĮµķÖŠ»ģÓŠÉŁĮæµÄCa(OH)2£¬³żČ„ÉŁĮæCa(OH)2µÄ·½·ØŹĒĻČ½«³Įµķ¼ÓČėµ½Ź¢ÓŠ ČÜŅŗµÄÉÕ±ÖŠ£¬³ä·Ö½Į°čŗó¾ ”¢ (Ģī²Ł×÷·½·Ø)æÉµĆ“æ¾»µÄMg(OH)2”£
(3)ĻĀĶ¼ŹĒøĆŠĖȤŠ”×éÉč¼Ę½ųŠŠ¹ż³Ģ¢ŪµÄŹµŃé×°ÖĆĶ¼£ŗ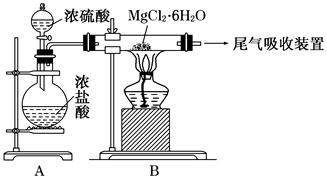
Ęä֊װÖĆAµÄ×÷ÓĆŹĒ ”£
(4)Š“³ö¹ż³Ģ¢ÜÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com