
| A. | 沸点:NH3>H2O>HF | B. | 熔点:金刚石>碳化硅>晶体硅 | ||
| C. | 硬度:白磷>冰>二氧化硅 | D. | 熔点:SiI4<SiBr4<SiCl4 |
分析 A.均含氢键,但水中氢键数目最多;
B.均为原子晶体,共价键越短,键能越大,熔点越高;
C.白磷、冰均为分子晶体,二氧化硅为原子晶体;
D.均为分子晶体,相对分子质量越大,熔点越大.
解答 解:A.均含氢键,但水中氢键数目最多,则沸点:H2O>HF>NH3,故A错误;
B.均为原子晶体,共价键越短,键能越大,熔点越高,则熔点:金刚石>碳化硅>晶体硅,故B正确;
C.白磷、冰均为分子晶体,二氧化硅为原子晶体,原子晶体的硬度大,则硬度:二氧化硅>白磷>冰,故C错误;
D.均为分子晶体,相对分子质量越大,熔点越大,则熔点:SiI4>SiBr4>SiCl4,故D错误;
故选B.
点评 本题考查晶体及性质,为高频考点,把握晶体类型及作用力、晶体性质比较方法为解答的关键,侧重分析与应用能力的考查,注意晶体结构与性质的应用,题目难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | SiO2 | MgO | Fe2O3 | Al2O3 | CuO |
| 质量分数(%) | ? | 4.0 | 32 | 10.2 | 16 |
| Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
| 完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |
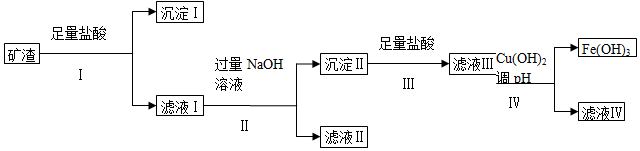
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
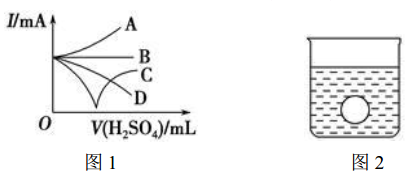
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 0.25mol | C. | 0.1mol | D. | 0.125mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
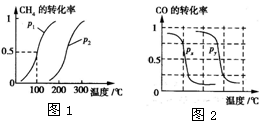 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | n | $\frac{1}{3}$ | 5 |
| 3 | 350 | m | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定不含NO3- | |
| B. | 该溶液中一定含K+,且c(K+)≥0.1mol/L | |
| C. | 该溶液中可能含K+ | |
| D. | 该溶液中肯定含有NO3?、SO42-、NH4+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| B. | 收集氯气用排饱和食盐水的方法 | |
| C. | 加压条件下有利于SO2和O2反应生成SO3 | |
| D. | 可用浓氨水和氢氧化钠固体快速制取氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com