
分析 (1)加入H2O2的目的是将溶液中的亚铁离子氧化成铁离子再调节pH值,将铁元素除去,据此书写离子方程式;
(2)在pH在9~10之间溶液A中,可以通过锌离子的物质的量计算出剩余EDTA的物质的量,调节pH在5~6时,通过锌离子的物质的量可计算出总EDTA的物质的量,由此可计算出与镁离子反应的EDTA的物质的量,根据$\frac{镁离子的质量}{样品的质量}$×100%计算出Mg2+的质量分数;
解答 解:(1)加入H2O2的目的是将溶液中的亚铁离子氧化成铁离子再调节pH值,将铁元素除去,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)Mg2+、Zn2+与EDTA均按1:1反应,在25mL溶液A中:n(EDTA)=n(Zn2+)=0.10×20.00×10-3=2.00×10-3mol
则100mL溶液A中剩余EDTA的量:n(EDTA)=2.00×10-3×100/25=8.00×10-3mol
25mL溶液A中EDTA的量:n(EDTA)总=n(Zn2+)=0.10×30.00×10-3=3.00×10-3mol
则100mL溶液A中EDTA总量:n(EDTA)总=3.00×10-3×4=0.0120mol
所以与1.5g样品中镁离子反应的EDTA的物质的量为0.012mol-8.00×10-3 mol=0.004mol,所以样品中n(Mg2+)=0.004mol,硫酸镁其质量为0.004mol×120g/mol=0.48g,
则该结晶硫酸镁中Mg2+的质量分数为=$\frac{0.48g}{1.5g}$×100%=32%,
故答案为:32%;
点评 本题考查了物质的制备、分离提纯实验方案的设计,注意把握习题中的信息、物质的性质及混合物分离方法为解答的关键,侧重分析与实验能力、以及计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2CO3 H2SiO3 H3PO4 | B. | HNO3 H3PO4 H2SO4 | ||
| C. | HI HBr HCl | D. | HClO HNO3 HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3+3H+ 明矾净水 | |
| C. | Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ 制备Fe(OH)3胶体 | |
| D. | SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2 | |
| B. | 向FeCl3溶液中加Mg(OH)2:3 Mg(OH)2+2Fe3+=2Fe(OH)3+3 Mg2+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
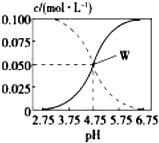 25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )
25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )| A. | pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)=c(CH3COOH) | |
| C. | pH=3的溶液中:c(H+)+c(Na+)+c(CH3COOH)=0.1mol/L | |
| D. | 据图象可求得该温度下CH3COOH的电离常数Ka=10-4.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
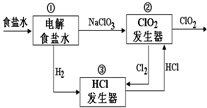 利用食盐水制取ClO2的工业流程如右图所示,
利用食盐水制取ClO2的工业流程如右图所示,| A. | 装置①中H2是阴极产物 | |
| B. | 装置②的阴极电极反应式为2ClO3-+12H++10e-=Cl2↑+6H2O | |
| C. | 该流程中Cl2、NaCl都可以循环利用 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害 | |
| C. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放 | |
| D. | 明矾常用于水体杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com