
����Ŀ�����������Ⱥ��ݵ��ܱ������н��������������淴Ӧ�����У�C(s)��H2O(g) ![]() CO(g)��H2(g)�����У�CO(g)��H2O(g)
CO(g)��H2(g)�����У�CO(g)��H2O(g) ![]() CO2(g)��H2(g)����������״̬�����������ƽ����Է����������ٸı� ������ʱ������ѹǿ���ٸı� �����������Ũ����� ����Ӧ��ϵ���¶ȱ��ֲ��� ��������������Ӧ���ʵ��ڶ����������Ӧ���ʵ�2�� ����������ܶȲ��� ����λʱ���ڣ�����ˮ����������������������֮��Ϊ9��1 ��ͬһʱ���ڣ�ˮ�������ĵ����ʵ��������������ĵ����ʵ����������ܱ����ס��������з�Ӧ���ﵽƽ��״̬����
CO2(g)��H2(g)����������״̬�����������ƽ����Է����������ٸı� ������ʱ������ѹǿ���ٸı� �����������Ũ����� ����Ӧ��ϵ���¶ȱ��ֲ��� ��������������Ӧ���ʵ��ڶ����������Ӧ���ʵ�2�� ����������ܶȲ��� ����λʱ���ڣ�����ˮ����������������������֮��Ϊ9��1 ��ͬһʱ���ڣ�ˮ�������ĵ����ʵ��������������ĵ����ʵ����������ܱ����ס��������з�Ӧ���ﵽƽ��״̬����
A. �ܢݢ� B. �ۢܢ� C. �ޢߢ� D. �٢ڢ�
���𰸡�A
���������������ҷ�Ӧ�ǵ�����Ŀ��淴Ӧ�������������ʼ�ղ��䣬����ƽ����Է�������ʼ�ղ��䣬���ж��ҷ�Ӧ�Ƿ�ﵽƽ��״̬���ʢٴ��ں���ʱ������ѹǿ���ٸı䣬�����ҷ�Ӧ�ǵ�����Ŀ��淴Ӧ��ѹǿʼ�ղ��䣬����ѹǿ�������ж����Ƿ�ﵽƽ��״̬���ʢڴ��۸��������Ũ����ȣ������жϸ���ֵ�Ũ�Ȳ��䣬��֤���ﵽ��ƽ��״̬���ʢ۴��ܷ�Ӧ��ϵ���¶ȱ��ֲ��䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬���ʢ���ȷ���ݶ��������������Ƕ�����������ʵ�2����˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬���ʢ���ȷ����������ܶȲ��䣬�����ҷ�Ӧ����������������ͬ�Ҷ������壬�������ݻ����䣬�����ܶ�ʼ�ղ��䣬���ж����Ƿ�ﵽƽ��״̬���ʢ��ߵ�λʱ���ڣ�����ˮ�����������ɵ�����������Ϊ9:1����ʾ�Ķ�������Ӧ���ʣ����ж����淴Ӧ�����Ƿ���ȣ��ʢߴ���ͬһʱ���ڣ�ˮ�������ĵ����ʵ��������������ĵ����ʵ�����˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬���ʢ���ȷ���ʴ�ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ������ȤС���ڴ�����ˮ��Ʒʱ���轫��������Ϊ37%��Ũ���ᣨ�ܶ�Ϊ1.19gcm��3�����Ƴ�250mL0.1molL��1��������Һ��
��1������ͼ��ʾ�����У�����������Һ����Ҫ����______����ͼ����Ӧ��������ĸ������ͼ�����������⣬����������Һ����Ҫ�IJ���������_______�������ð�ʹ�õ��Ⱥ�˳��ֱ���_______��_______��

��2�����ݼ��㣬�������̻����У���ʵ����ͲӦʹ�õ���______������ƿӦʹ��______����д��Ӧ����ţ���
A��10mL B��100mL C��250mL D��500mL
��3������ȡŨ��������в������Ⱥ�˳����______���ñ�ű�ʾ����
�ٴ�ϡ�͵������¶�������һ�º��ز�����ע����ѡ����������ƿ��
��������ƿ��С�ļ�����ˮ��Һ��ӽ����ο̶���1cm��2cm�������ý�ͷ�ιܼ�����ˮ��ʹ��Һ����ʹ���ƿ���Ļ��ο̶�������
����ʢ������ձ���ע����������ˮ�����ò��������裬ʹ���Ͼ���
��������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ע������ƿ
��4����������ƿ��ʹ�ã����в�����ȷ����______������ĸ����ͬ����
A��ʹ������ƿǰ������Ƿ�©ˮ
B������ƿ��ˮϴ����������õ�ϡHCl��Һ��ϴ
C��������Һʱ����������ǹ��壬�ѳƺõ�������ֽ��С�ĵ�������ƿ�У�������ˮ���ӽ��̶���1cm��2cm�������ý�ͷ�ιܼ�����ˮ���̶���
D��������Һʱ����������Һ�壬����Ͳ��ȡ������ֱ�ӵ�������ƿ�У�������ˮ���ӽ��̶���1cm��2cm�������ý�ͷ�ιܼ�����ˮ���̶���
E���Ǻ�ƿ�ǣ���ʳָ��סƿ������һֻ����סƿ�ף�������ƿ������ת��Σ�ҡ��
��5�������ݺ�ҡ�Ⱦ��ã����ְ�Һ������ߣ���ʱӦ��______��
A��ֱ��ת�Ƶ�ϸ���Լ�ƿ��
B�����ý�ͷ�ιܼ�ˮ�����¶���
C��������Һ��������������
D��ֱ�Ӵ���������ƿ��
��6����������ʱ������������ȷ��ֻ��������ijһ��������ж������Ƶ���ҺŨ�������Ҫ���ֵ����0.1molL��1����α仯����a��ƫ�ߣ�b��ƫ�ͣ�c����Ӱ�죬�����к���������Ӧ����ĸ����
������ƿ������������ˮ______��
���ձ��Ͳ�����û��ϴ��2��3��______��
�����Ƶ���Һװ��ྻ�ĵ�����������ˮ���Լ�ƿ��______��
��������ʱ���ӣ�������Һ�����ʵ���Ũ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ���ɻ�ȡO2�������й�˵������ȷ����
�ٹ���ֽ�ˮ��������2H2O(l)��2H2(g) + O2(g) ��H1��+571.6 kJ��mol��1
�ڹ�������ֽ���������2H2O2(l)��2H2O(l) + O2(g) ��H2����196.4 kJ��mol��1
��һ�������ֽ���������2NO(g)��N2(g) + O2(g) ��H3����180.5 kJ��mol��1
A. ��Ӧ�������ǻ�ȡH2��;��֮һ
B. ��Ӧ�����۶��ǻ�ѧ��ת��Ϊ����
C. ��ӦH2O2(l)��H2O(g)+ ![]() O2(g)����H����98.2 kJ��mol��1
O2(g)����H����98.2 kJ��mol��1
D. ��Ӧ2H2(g)+2NO(g)��N2(g)+2H2O(l)����H����752.1 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Yohiaki Nakao����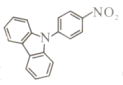 (b)��Pd���¿ɷ���Buchwald-Hartwigż����Ӧ������˵������ȷ����
(b)��Pd���¿ɷ���Buchwald-Hartwigż����Ӧ������˵������ȷ����
A. b�ķ���ʽΪC18H12N2O2
B. b��һ�ȴ�����4��
C. b�ɷ���ȡ����Ӧ
D. b������ԭ�Ӳ�һ����ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������Ҫ����2molL��1��NaCl��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡ��NaCl�����ֱ��ǣ� ��
A.950 mL��111.2 g
B.1000 mL��117 g
C.500 mL��117 g
D.1000 mL��111.2 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��������У�����˵����Ӧ��C(s) +CO2(g)![]() 2CO(g)�Ѵﵽƽ��״̬����
2CO(g)�Ѵﵽƽ��״̬����
A. ÿ����1 mol CO2��ͬʱ����2 mol CO
B. ��������ƽ����Է����������ٸı�
C. �����������ѹǿ���ٸı�
D. ������������ܶȲ��ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����þ��й���ǰ����
(1)���辭����ѧ�仯���ܴӺ�ˮ�л�õ�������________(�����)��
A��Cl2 B����ˮ C���ռ� D��ʳ��
(2)�Ӻ�ˮ����ȡ�����Ҫ��������Ũ���ĺ�ˮ��ͨ��Cl2����Br-�������÷�Ӧ�����ӷ���ʽ��____��
(3)��ͼ�ǴӺ�ˮ����ȡþ�ļ����̡�

�ٹ�ҵ�ϳ����ڳ���Mg2+���Լ�A��________��תMg(OH)2��ΪMgCl2�����ӷ���ʽ��____________��
������ˮMgCl2��ȡMg�Ļ�ѧ����ʽ��________________________��
(4)�������и�����I����ʽ���ڵĵ�Ԫ�ء�ʵ������ȡI2��;��������ʾ��
![]()
�����պ���ʱ���õ���Ҫ����������________________��
�����ữ����Һ�м�H2O2��Һ��д���÷�Ӧ�����ӷ���ʽ_______________________��
��Ӧ�������ټ���CCl4����ȡ���������ã����Թ۲쵽CCl4���________ɫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com