
分析 (1)欲配制480mL 0.2mol•L-1的碳酸钠溶液,应选择500ml容量瓶,依据m=CVM计算需要溶质的质量;
(2)根据天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即药品质量=砝码质量+游码质量,如果位置放反,根据左盘的质量=右盘的质量=右盘的质量+游码的质量,列等式进行计算;
(3)依据配制一定物质的量浓度溶液一般步骤选择合适的仪器;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{m}{V}$进行误差分析.
解答 解:(1)欲配制480mL 0.2mol•L-1的碳酸钠溶液,应选择500ml容量瓶,需要碳酸钠的质量=0.2mol•L-1×0.5L×106g/mol=10.6g;
故答案为:10.6;
(2)药品质量=砝码质量-游码质量,即药品质量=10.0g-0.6g=9.4g;
故答案为:9.4;
(3)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平(带砝码)、烧杯、药匙、量筒、称量纸玻璃棒、500ml容量瓶、胶头滴管;
故答案为:500ml容量瓶、胶头滴管;
(4)①若称取28.6gNaCO3•10H2O进行配制,称取的溶质中含碳酸钠的物质的量偏小,溶液的浓度偏低,故不选;
②称量时选用了生锈的砝码,导致称取的溶质的物质的量偏大,溶液的浓度偏高,故选;
③往容量瓶转移溶液时有少量的液体溅出,导致溶质的物质的量偏小,溶液的浓度偏低,故不选;
④碳酸钠中有不溶性杂质,导致溶质的物质的量偏小,溶液的浓度偏低,故不选;
⑤未洗涤溶解碳酸钠的烧杯,导致溶质的物质的量偏小,溶液的浓度偏低,故不选;
⑥定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高,故选;
⑦容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积都不会产生影响,溶液浓度不变,故不选;
故选:②⑥.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理和过程是解题关键,题目难度不大.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p1 | B. | 1s22s22p33s1 | ||
| C. | 1s22s22p63s23p63d104s2 | D. | 1s22s22p63s23p63d34s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期中同主族元素的最外层电子数及化学性质完全相同 | |
| D. | 同周期元素的原子半径从左到右依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 沸点:CH4>SiH4>GeH4>SnH4 | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
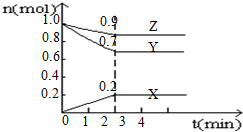 某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
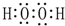 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .⑦的电子式为
.⑦的电子式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com