
【题目】(选做题)本题包括A、B两小题。请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
钴的合金及其配合物用途非常广泛。
(1)Co3+基态核外电子排布式为_____。
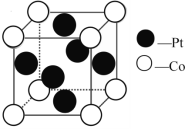
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为_____。
(3)BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为_____(用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_____(已知CO32—的结构式为:![]() )。
)。
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含![]() 键的数目为_____。
键的数目为_____。
B.[实验化学]
EDTA(乙二胺四乙酸)是螯合剂的代表物(沸点为116~117.2℃),可用于制备EDTAFeNa·3H2O等。实验室制备EDTA的实验步骤如下:
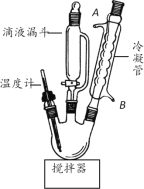
步骤1:在三口烧瓶中加入22.5gClCH2COOH、45mLH2O搅拌至溶解;在不断搅拌下,将含22gNaOH、60mLH2O、6.6g H2NCH2CH2NH2的盐酸盐所配成的溶液,从滴液漏斗中不断滴加到三口烧瓶中。
步骤2:加料完毕后,升温到102~106℃并保温,调节并保持 pH约为9,搅拌2h。
步骤3:加入活性炭,搅拌、静置、过滤。
步骤4:滤液用盐酸酸化至pH=1,放置、结晶、过滤、洗涤、干燥,制得EDTA。
(1)图中冷凝管装置的作用是_____,水从接口_____(填标号)通入。
(2)步骤3中加入活性炭的目的是_____;测定溶液pH的方法是_____。
(3)步骤4中“洗涤”时,能说明已洗涤完全的方法是_____。
(4)请补充完整由EDTA、NaHCO3、FeCl3·6H2O为原料制备EDTAFeNa·3H2O的实验方案(已知EDTANa4+FeCl3![]() EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
【答案】[Ar]3d6或1s22s22p63s23p63d6 Pt3Co 正四面体 N和O sp和sp2 9NA 冷凝回流水和EDTA B 脱色 用玻璃棒蘸取溶液滴在pH试纸上,半分钟内与标准比色卡比较 取少量最后一次的洗涤过滤液于试管中,向其中滴加硝酸酸化的AgNO3溶液,若不产生白色沉淀,则表明已洗涤完全 将溶液加热到80℃并保温,分次加入26.8gNaHCO3,搅拌至溶液中无气泡
【解析】
A.(1)Co位于第四周期第VIII族,Co3+核外电子排布式为 [Ar]3d6或1s22s22p63s23p63d6 ;
(2)Co位于晶胞的顶点,个数为8×1/8=1,Pt位于晶胞的面心,个数为6×1/2=3,因此化学式为Pt3Co;
(3)①ClO4-中心原子Cl有4个σ键,孤电子对数为(7+1-4×2)/2=0,价层电子对数为4,ClO4-的空间构型为正四面体形;
②构成配位键,和中心原子提供空轨道,配原子提供孤电子对,根据CTCN的化学式,以及CO32-的结构式,与Co(III)形成配位键的原子是N和O;
③前一个C原子,有3个σ键,无孤电子对,杂化类型为sp2,后一个碳原子有2个σ键,无孤电子对,杂化类型为sp;成键原子之间只能形成一个σ键,即1mol该分子中含有σ键物质的量为9mol,个数为9NA。
B.(1)冷凝管的作用是冷凝回流水和EDTA;冷凝水进水方向一般是下进上出,即从接口B处通入;
(2)活性炭具有吸附性,能吸附有色物质,即加入活性炭的目的是脱色;测定溶液pH的方法是用玻璃棒蘸取溶液滴在pH试纸上,半分钟内与标准比色卡比较;
(3)EDTA表面含有Cl-,因此检验已洗涤完全的方法是检验Cl-是否存在,具体操作是取少量最后一次的洗涤过滤液于试管中,向其中滴加硝酸酸化的AgNO3溶液,若不产生白色沉淀,则表明已洗涤完全;
(4)根据反应方程式,温度在80℃时发生反应,根据所给原料以及后续实验,操作是将溶液加热到80℃并保温,分次加入26.8gNaHCO3,搅拌至溶液中无气泡;


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。

(1)若以A点表示25 ℃时水在电离平衡时的离子浓度,当温度升到100 ℃时,水的电离平衡状态到B点,则100 ℃时,水的离子积为______________。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100 ℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为_______________________。
(3)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_________________________,由水电离出的c(OH-)=_______________mol·L-1。
(4)等体积的下列溶液中,阴离子的总物质的量最大的是_____________(填序号)。
①0.1 mol·L-1的CuSO4溶液 ②0.1 mol·L-1的Na2CO3
③0.1 mol·L-1的KCl ④0.1 mol·L-1的NaHCO3
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-,HA-H++A2-。
①则Na2A溶液显__________(填“酸性”“中性”或“碱性”);NaHA溶液显__________(填“酸性”“中性”或“碱性”)。
②现有0.1 mol·L-1 Na2A的溶液,其中各种微粒浓度关系正确的是__________(填字母)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)
B.c(Na+)=2c(HA-)+2c((A2-)+2c(H2A)
C.c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D.c(OH-)=c(HA-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图中a曲线表示一定条件下可逆反应X(g)+Y(g) ![]() 2Z(g)+W(s);(正反应放热)的反应过程。要使a曲线变为b曲线,可采取的措施是
2Z(g)+W(s);(正反应放热)的反应过程。要使a曲线变为b曲线,可采取的措施是

A. 加入催化剂
B. 增大Y的浓度
C. 降低温度
D. 减小体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-=SO32-+H2O
C. 进入离心机的分散系是悬浊液
D. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是恒温条件下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是

A. 反应达到平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡状态Ⅰ后,增大体系压强,平衡发生移动,达到平衡状态Ⅱ
C. 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D. 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是( )
A. 向含1 mol Ca(HCO3)2的溶液中加入1 mol Na2O2
B. 向带有氧化膜的铝片中加入盐酸
C. 向漂白粉溶液中通入过量CO2
D. 向含1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图所示装置实现路线图中的部分转化:

下列叙述正确的是
A. 乙醇在铜网表面被还原
B. 甲、乙烧杯中的水均起到冷却作用
C. 试管a收集到的液体中至少有两种有机物
D. 实验开始后熄灭酒精灯,铜网仍能红热,说明发生的是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )

A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应N2(g)+3H2(g)![]() 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。

请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变________(填“大”或“小”),E的大小对该反应的反应热有无影响?_______。理由是____________________________;
(2)图中ΔH=______kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2 ,经过50 min,NH3的浓度为1mol·L-1,则v(N2)=_________mol·L-1·min-1、c(H2)=___________mol·L-1;
(4)已知NH3(g)=== NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)===2NH3 (l)的热化学方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com