
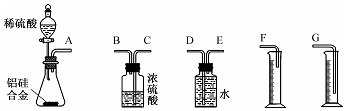
���� ��1��װ�õ���װ˳�Ͻ���ˮ��Ӧ������ˮ�������ⶨ���������������ʢˮ���Լ�ƿ����һ��Ҫ�̽�����������ѹǿԭ����ˮ�ų�����Ͳ��ˮ��������������������������Ͳ�ڵ���Ӧ������Ͳ�ײ���
��2��þ������ϡ���ᷴӦ�������������壬ʹ��ƿ������ѹǿ���
��3������ϡ���ᷴӦ������������������
��4�����ַ�Һ©��������ѹǿ����ƿ������ѹǿ����Ƕ�ȡʾ���Ĺؼ��㣻
��5�������Ͻ��У�ֻ�н��������Ժ����ᷴӦ�����������������֮�䲻��Ӧ�����ݻ�ѧ��Ӧ�����Ĺ�ϵ�����㼴�ɣ�
��� �⣺��1����װ�õ���װ˳�Ͻ���ˮ��Ӧ������ˮ�������ⶨ���������������ʢˮ���Լ�ƿ����һ��Ҫ�̽���������������ѹǿԭ����ˮ�ų�����Ͳ��ˮ��������������������������Ͳ�ڵ���Ӧ������Ͳ�ײ���������˳��Ϊ��E��D��G��
�ʴ�Ϊ��E��D��G��
��2��þ������ϡ���ᷴӦ�������������壬ʹ��ƿ������ѹǿ����������˳��������ƿ��
�ʴ�Ϊ������ϡ���ᷴӦ�������������壬ʹ��ƿ������ѹǿ���
��3����������ϡ���ᷴӦ�����ӷ���ʽΪ2Al+6H+=2Al3++3H2�����ʴ�Ϊ��2Al+6H+=2Al3++3H2����
��4��������ѹԭ������ʵ��װ����ȴ�������ƶ���Ͳʹ����Һ������ƿ��Һ����ƽ����ƽ�Ӷ�ȡ��Ͳ��ˮ���������ʱ�������Ϊ���³�ѹ�µ��������������ͨ��״��ʱ�������
�ʴ�Ϊ����ʵ��װ����ȴ�������ƶ���Ͳʹ����Һ������ƿ��Һ����ƽ����ƽ�Ӷ�ȡ��Ͳ��ˮ���������������ͨ��״��ʱ�������
��5��ʵ��ǰ����Ͻ������m1 g��ʵ���������������m2 g�����������������m1-m2��ʵ�����Ͳ��Һ�����ΪVmL�����������������ʵ�����$\frac{V��1{0}^{-3}}{{V}_{m}}$�����ݻ�ѧ��Ӧԭ����
2Al��3H2��
2 3
$\frac{{m}_{1}-{m}_{2}}{27}$ $\frac{V��1{0}^{-3}}{{V}_{m}}$
���Vm=$\frac{9V}{500��{m}_{1}-{m}_{2}��}$L•moL-1�����Ͻ��к��н���ͭ�����������֮�䷴Ӧ���ͺ��й���һ���Ľ����
�ʴ�Ϊ��$\frac{9V}{500��{m}_{1}-{m}_{2}��}$����Ӱ�죮
���� ������Ҫ�������ʺ����IJⶨ����ʵ��ԭ����װ�õ����⡢ʵ�鷽����Ƶȣ���Ŀ�Ѷ��еȣ�����ʵ��ԭ���ǽ���Ĺؼ����Ƕ�֪ʶ���ۺϿ��飬��Ҫѧ������֪ʶ�Ļ������ۺ�����֪ʶ�������⡢��������������


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д� ״Ԫ����ϵ�д�
״Ԫ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 7.1g����������������������Һ��Ӧת�Ƶĵ�����Ϊ0.2��6.02��1023 | |
| B�� | 50ml 12mol/L����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3NA | |
| C�� | 0.1molNa2O2������������̼��ַ�Ӧת�Ƶĵ�����Ϊ0.2NA | |
| D�� | 0.1molFe��0.1mol������ȼ�գ�ת�Ƶĵ�����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe2+��H+��NO3-��Cl- | B�� | H+��Na+��Cl-��CO32- | ||
| C�� | Na+��Mg2+��OH-��SO42- | D�� | K+��Na+��OH-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ��˳�� | ʵ������ | ʵ������ | ʵ��˳�� | ʵ������ | ʵ������ | |
| �� | A+B | ���ɰ�ɫ���� | �� | B+C | �����Ա仯 | |
| �� | A+C | �ų���ɫ���� | �� | B+D | ���ɰ�ɫ���� | |
| �� | A+D | �ų���ɫ���� | �� | C+D | �����Ա仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5.6 g Fe ��������������ȫȼ��ʧȥ������Ϊ 3N A | |
| B�� | 1L Ũ��Ϊ 0.5mol/LFeCl3 ��Һ������к����� 0.5molFe��OH��3�������� | |
| C�� | ���³�ѹ�£�23 g NO2 �� N2O4 �Ļ������һ������ N A ����ԭ�� | |
| D�� | ����£�4.48L ��ˮ�к��� H2O ���ӵ���ĿΪ 0.2N A |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molNa2CO3Լ����6.02��1023��Na2CO3���� | |
| B�� | 2molH2O��Ħ������Ϊ36g/mol | |
| C�� | ��״���£�22.4LCH4���еĵ�����Ϊ10NA | |
| D�� | ���ʵ���Ũ��Ϊ0.5mol/L��MgCl2��Һ�У�����Cl-����Ϊ1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2��g��+O2��g���T2H2O��l����H=-142.9 kJ•mol-1 | |
| B�� | 2H2��g��+O2��g���T2H2O��l����H=+571.6 kJ•mol-1 | |
| C�� | 2H2+O2�T2H2O��H=-571.6 kJ•mol-1 | |
| D�� | 2H2��g��+O2��g���T2H2O��l����H=-571.6 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���߶�������ˮ���Ҷ��ܺ�ˮ��Ӧ��ǰ�ߵ��ܽ�ȴ��ں��� | |
| B�� | ���߶�����������θ����༲����ǰ�ߵ�Ч�����ں��� | |
| C�� | ������Na2CO3��NaHCO3�ֱ�������ʵ�����ϡ���ᷴӦ��ǰ�߲���CO2�� | |
| D�� | �������Ũ�ȵ�AlCl3��Һ�ֱ��������Na2CO3��NaHCO3��Ӧ��ǰ�߲���CO2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com