
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:X>Z | |
| C. | Y、Z的氧化物都有两性 | |
| D. | 最高价氧化物对应水化物的碱性:Y>W |
分析 某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,且 原子序数依次增大,Y、Z处于相邻主族,X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;Y、Z处于相邻主族,Y、W为金属元素,则Y、Z为第三周期元素,W为第四周期元素,若W为K元素,则Y、Z最外层电子数之和等于7,可得Y元素为Al元素、Z元素为Si元素;若W为Ca元素,则Y、Z最外层电子数之和等于8不符合题意.
解答 解:某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,且 原子序数依次增大,Y、Z处于相邻主族,X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;Y、Z处于相邻主族,Y、W为金属元素,则Y、Z为第三周期元素,W为第四周期元素,若W为K元素,则Y、Z最外层电子数之和等于7,可得Y元素为Al元素、Z元素为Si元素;若W为Ca元素,则Y、Z最外层电子数之和等于8不符合题意.
A.根据电子层数越多半径越大,同一周期从左到右半径越小,故原子半径:W(K)>Y(Al)>Z(Si)>X(O),故A正确;
B.O元素的非金属性比Si元素非金属性强,气态氢化物的稳定性:X>Z,故B正确;
C.Al2O3为两性氧化物,而SiO2不是两性氧化物,故C错误;
D.最高价氧化物对应的水化物碱性强弱与元素的金属性强弱有关,由于K元素金属性比Al元素金属性强,最高价氧化物对应水化物的碱性:W>Y,故D错误.
故选AB.
点评 本题考查原子结构与元素周期律的关系,为高频考点,把握元素的推断为解答的关键,侧重分析与推断能力的考查,注意原子结构关系及元素周期律应用,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | C(s)+CO2(g)?2CO(g) (正反应为吸热反应) | |
| C. | 2NO2(g)?N2O4(g) (正反应为放热反应) | |
| D. | 3O2(g)?2O3(g) (正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
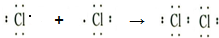 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的C、H、O的个数比为1:2:n(n为正整数) | |
| B. | 分子中C、H个数比为1:2 | |
| C. | 该有机物可能为苯的同系物 | |
| D. | 该分子中肯定不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 衣服上的油脂可用汽油洗去 | |
| B. | 利用油脂在酸性条件下的水解,可以生产甘油和肥皂 | |
| C. | 油脂在酸性条件下比在碱性条件下更容易水解 | |
| D. | 脂肪是有机体组织里储存能量的重要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
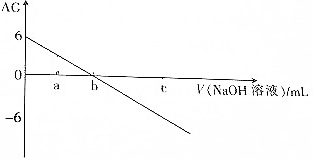
| A. | 若a点加入NaOH溶液的体积为10mL,则溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | b点加入NaOH溶液的体积为20mL | |
| C. | b点时,溶液中存在:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 若c点加入NaOH溶液的体积为40mL,则溶液中:c(CH3COO-)+2c(CH3C00H)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O含电子数目为10NA | |
| B. | 标准状况下,NA个HF分子所占的何种约为22.4L | |
| C. | 4.5g SiO2晶体中含有的硅氧键的数目为0.3NA | |
| D. | 常温下将0.1mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的NaHSO4溶液,PH=1 | B. | 0.1mol/L的H2SO4溶液,PH>1 | ||
| C. | 0.01mol/L的NaOH溶液,PH=10 | D. | pH=9的NaOH溶液稀释1000倍,PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取a g混合物用酒精灯充分加热后质量减少bg | |
| B. | 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加bg | |
| C. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴甲基橙指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL | |
| D. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴酚酞指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com