
【题目】一定温度下,反应X2(g)+H2(g)![]() 2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A. 5% B. 17% C. 25% D. 33%
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式![]()
D. 若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有位于周期表中的七种元素,试按下述所给的条件推断。
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F在常温下是气体,性质稳定,是除氢气外最轻的气体。
④G是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)A的名称是________;B位于周期表中第______周期,第________族;C的原子结构示意图是________。
(2)E单质的颜色是________。
(3)A元素与D元素形成化合物的电子式是___________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是______;气态氢化物最稳定的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更好地解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源。以下做法不能提高燃料效率的是 ( )
A.煤的气化与液化
B.液体燃料呈雾状喷出
C.通入大量的空气
D.将煤块粉碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol/L两种气体X2和Y2,在密闭容器中反应生成气体Z ,经过t min后,测得物质的浓度为 (X2)=0.4mol/L,c(Y2)=0.8mol/L,c(Z)=0.4mol/L,则该反应的反应式可表示为( )
A.X2+2Y2=2Z B.2X2 +2Y2=2Z
C.3X2+Y2=2Z D.X2+3Y2=2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1L 1.0molL-1NaOH溶液吸收0.8molSO2,所得溶液中的SO32-和HSO3-的物质的量浓度之比最接近于( )
A.2:1 B.1:3 C.3:2 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
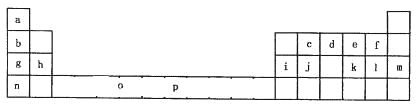
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】工业制硫酸,利用催化氧化反应将SO2转化为SO3是一个关键步骤。请回答:
(1)某温度下,SO2(g)+O2(g)![]() SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
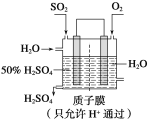
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______。
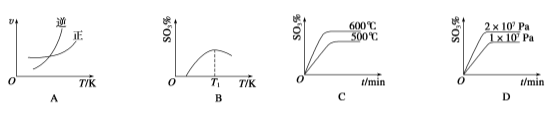
(4)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,一定正确的是________(填序号)。
2SO3(g)反应的图像中,一定正确的是________(填序号)。
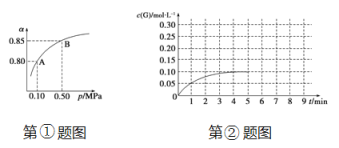
(5)①某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。当平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图画出此变化过程中SO3(g)浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O氯化完成后过滤。

①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com