
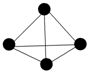
 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子. N4分子结构如图,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N键放出942kJ热量.根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子. N4分子结构如图,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N键放出942kJ热量.根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )| A. | +882 kJ/mol | B. | +441 kJ/mol | C. | -882 kJ/mol | D. | -441 kJ/mol |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可用于泡沫灭火剂 | B. | 明矾能做净水剂 | ||
| C. | 氯气可作自来水消毒剂 | D. | 铝热反应可用来焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变是指在恒压、恒温下,体系不做体积功,只做其它功的变化过程的热效应 | |
| B. | 书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热 | |
| C. | 化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的 | |
| D. | 吸热反应的△H<0,放热反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子里含有双键的有机物一定是烯烃 | |
| B. | 分子里含有苯环和羟基的化合物一定属于酚类 | |
| C. | 醛类的通式是CnH2nO(n≥1) | |
| D. | 相对分子质量为46的烃的含氧衍生物不一定是乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 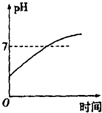 | B. | 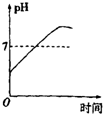 | C. | 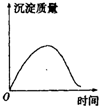 | D. | 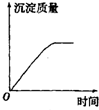 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
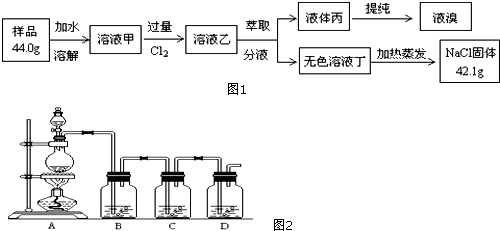
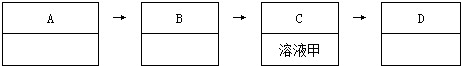
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
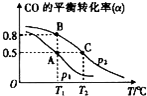 SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.
SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com