
| A. | Mg和 Al | B. | Al和 Fe | C. | Mg和 Fe | D. | Na和 Al |
分析 假设金属均为+2价,根据电子转移守恒计算金属物质的量,再根据M=$\frac{m}{n}$计算平均相对原子质量,据此判断,注意Al看作+2价,相对原子质量等效为27×$\frac{2}{3}$=18,Na看作+2价,相对原子质量等效为46,若金属与盐酸反应,相对原子质量视作无穷大.
解答 解:标况下22.4L氢气为1mol,假设金属均为+2价,根据电子转移守恒,金属物质的量为$\frac{1mol×2}{2}$=1mol,平均相对原子质量为$\frac{25}{1}$=25.
A.Mg相对原子质量为24,Al看作+2价,相对原子质量等效为27×$\frac{2}{3}$=18,平均相对原子质量小于25,故A错误;
B.Al看作+2价,相对原子质量等效为27×$\frac{2}{3}$=18,Fe的相对原子质量为56,平均相对原子质量可以为25,故B正确;
C.Mg相对原子质量为24,Fe的相对原子质量为56,平均相对原子质量可以为25,故C正确;
D.Al看作+2价,相对原子质量等效为27×$\frac{2}{3}$=18,Na看作+2价,相对原子质量等效为46,平均相对原子质量可以为25,故D正确,
故选A.
点评 本题考查混合物有关计算,注意利用平均相对原子质量解答,注意化合价与相对原子质量等效关系,可以利用极限法,但计算量较大,侧重考查学生分析计算能力,难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式::N:::N: | B. | 乙醇的结构简式C2H6O | ||
| C. | 芳香烃的通式为CnH2n-6(n≥6) | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液中滴入硝酸银溶液 | |
| B. | 氢气还原氧化铜 | |
| C. | 铁片置于硫酸铜溶液中 | |
| D. | 用氢氧化钠溶液溶解带氧化膜的铝片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-═3Cl-+ClO-+H2O | |
| B. | 盐酸与石灰石反应:2H++CO32-═H2O+CO2↑ | |
| C. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
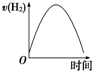 镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )
镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )| A. | 镁条的质量 | B. | 镁条的表面积 | C. | Cl-的浓度 | D. | 压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 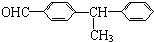 | B. | 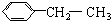 | ||
| C. | CH2=CHCH=CHCH=CH2 | D. | (CH3)2CH-C≡C-CH=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
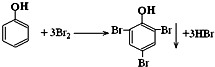
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L的AlCl3溶液中,阳离子总数大于0.2NA | |
| B. | 工业制取漂白粉时,理论上每制得25.4g产品,反应中转移电子数为0.2NA | |
| C. | 30g甲酸甲酯与30g葡萄糖中含C-H键个数均为2NA | |
| D. | 将2.7g铝粉投入足量的热的浓硝酸中充分反应,可收集到标况下气体6.72 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com