
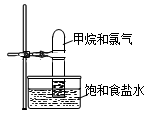
 将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.
将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.分析 CH4与氯气在光照条件下发生取代反应生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,其中CH3Cl是气体,CH2Cl2、CHCl3、CCl4是油状液体,HCl极易溶于水,故生成后溶于了饱和氯化钠溶液,导致试管内压强减小,液面上升,据此分析.
解答 解:(1)CH4与氯气在光照条件下发生取代反应生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,其中CH3Cl是气体,CH2Cl2、CHCl3、CCl4是油状液体,难溶于水,HCl极易溶于水,故HCl生成后溶于了饱和食盐水中,油状液滴的成分有CH2Cl2、CHCl3、CCl4,故答案为:CHCl3(或CH2Cl2);
(2)由于HCl极易溶于水,而氯气在水中的额溶解度不大,且氯气和水的反应为可逆反应,故水槽中盛放饱和食盐水不影响HCl的溶解,而能降低氯气的溶解度,故目的是为了抑制氯气和水的反应,故答案为:氯气;
(3)由于反应生成的CH2Cl2、CHCl3、CCl4是油状液体,而HCl极易溶于水,生成后溶于了饱和氯化钠溶液,导致试管内压强减小,液面上升,故答案为:HCl.
点评 本题考查了甲烷和氯气发生取代反应后产物的状态、在水中的溶解性等问题,难度不大,应注意饱和食盐水能抑制氯气的溶解,但对HCl的溶解度无大的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 体积V/ml | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒、有害物质 | |
| B. | Na2S具有还原性,作废水中Cu2+、Hg2+沉淀剂 | |
| C. | 石墨烯一种由单层碳原子构成的新纳米材料,具有导电性 | |
| D. | 刚玉、红宝石主要或分是氧化铝,陶瓷、分子筛主要成分是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C三种核素互为同素异形体 | |
| B. | 苯甲醇和邻甲基苯酚的分子式相同,化学性质也相同 | |
| C. | 等质量的甲烷按a、b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH4$→_{催化重整}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )
黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )| A. | AFBI分子中有2个手性碳原子 | B. | AFBI分子中所有原子处于同一平面 | ||
| C. | 1moIAFBI最多可与2moINaOH反应 | D. | 1molAFBI最多可与5molH2发生加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | ||
| B | ||
| C |
| A. | A是一种活泼金属元素 | |
| B. | C的最高价氧化物的水化物是强酸 | |
| C. | B的氢氧化物是强碱 | |
| D. | C的最高价氧化物对应的水化物能与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com