
 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 属于芳香族化合物 | |
| B. | 能发生消去反应和酯化反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH | |
| D. | 能分别与金属Na、NaHCO3溶液反应 |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小电负性越大 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M | |
| D. | 主族元素的最高正化合价等于该元素原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol CO(g)+1/2O2(g)═CO2(g),△H=-283.0 kJ/mol C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 在0.1mol/L的氨水中加水稀释,氨水的导电能力降低 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 Cu2+>Fe2+ | B. | 氧化性 Fe3+>Cu2+ | ||
| C. | 还原性 Fe2+>Cu | D. | 还原性 Fe>Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和Ba(NO3)2的混合溶液 | B. | BaCl2溶液 | ||
| C. | NaOH溶液 | D. | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①=②>③>④>⑤ | B. | ④>③>①=⑤>② | C. | ③>①>②>④>⑤ | D. | ④>③>①>⑤>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0℃101kpa下22.4L氦气含质子的数目为4NA | |
| B. | 将CO2通入Na2O2使其增重a g时,反应中转移电子数目为NA | |
| C. | 标况下,将2.24L NH3溶于100ml水,所得溶液中粒子个数关系N(NH4+)+N(NH3•H2O)=0.1NA | |
| D. | 常温常压下14g氮气所含共用电子对数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
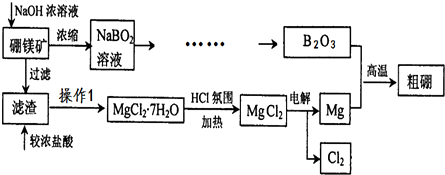

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com