
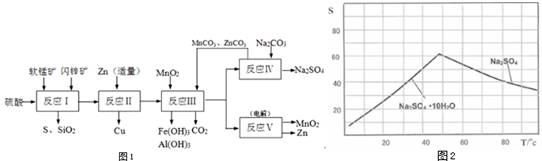
分析 14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,得到的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3,滴入几滴淀粉溶液作指示剂,用0.1000mol•L-1的标准Na2S2O3溶液滴定,发生的反应为I2+2S2O32-=2I-+S4O62-,据此测定软锰矿中MnO2含量,
Ⅰ.(1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32-=2I-+S4O62-,MnO2~I2~2S2O32-,依据离子方程式定量关系计算,注意溶液体积的变化;
Ⅱ.(2)生成CuSO4和MnSO4的化学方程式是MnO2,CuS在酸性溶液中发生的氧化还原反应,氧化剂为MnO2,被还原为硫酸锰,还原剂为CuS,被氧化为硫单质同时生成硫酸铜,依据电子守恒和原子守恒写出化学方程式判断;
(3)流程图分析,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会和亚铁离子反应生成铁单质;
(4)依据图象的溶解度随温度变化分析判断,得到硫酸钠的适宜条件,注意溶解度的影响;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极失电子生成,据此书写化学方程式;
(6)可以循环利用的物质是反应过程中重复使用,最后又生成可以进行循环使用.
解答 解:14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,得到的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3,滴入几滴淀粉溶液作指示剂,用0.1000mol•L-1的标准Na2S2O3溶液滴定,发生的反应为I2+2S2O32-=2I-+S4O62-,据此测定软锰矿中MnO2含量,
Ⅰ.(1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32-=2I-+S4O62-,
MnO2~I2~2S2O32-,
1 2
n 0.1000mol•L-1×0.050L
n=0.0025mol
1L溶液中含MnO2物质的量=0.0025mol×$\frac{1000}{25}$=0.1mol,
则软锰矿中MnO2含量=$\frac{0.1mol×87g/mol}{14.5g}$×100%=60%,
故答案为:60%;
Ⅱ.(2)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4和MnSO4硫单质,反应的化学方程式为:MnO2+CuS+2H2SO4=S↓+CuSO4+MnSO4+2H2O,
故答案为:2H2SO4;S;2H2O;
(3)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会继续反应置换出铁;反应的离子方程式为:Zn+Fe2+=Fe+Zn2+,
故答案为:将溶液中的硫酸铜转化为铜;Zn+Fe2+=Fe+Zn2+;
(4)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,
故答案为:趁热过滤;防止Na2SO4固体因溶解而减少,防止Na2SO4固体转变为Na2SO4•10H2O晶体;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出,电极反应为:Zn2++2e-=Zn;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,反应的化学方程式为:MnSO4+ZnSO4+2H2$\frac{\underline{\;通电\;}}{\;}$Zn+MnO2+2H2SO4,
故答案为:MnSO4+ZnSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$Zn+MnO2+2H2SO4;
(6)依据流程图可知能循环使用的物质为Zn、ZnCO3、MnCO3和MnO2,
故答案为:Zn.
点评 本题考查了物质制备实验的分析判断,物质溶解性的理解应用,电解原理的应用判断.电极反应的产物判断和电极反应书写,题目难度较大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一主族的元素从上到下金属性逐渐减弱 | |
| B. | 元素周期表是元素周期律的具体表现形式 | |
| C. | 同一周期从左到右,元素原子半径逐渐增大 | |
| D. | 非金属元素的最高正化合价等于它的负化合价的绝对值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+ )•c(OH- )=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
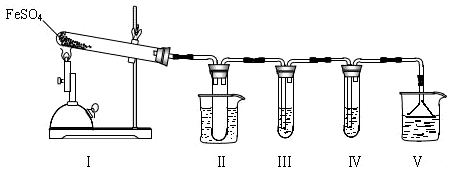
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5 mol•L -1 BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01 mol•L-1 酸性 KMnO4 溶液(或0.0l mol•L-1 溴水). | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com