
 2Al+2OH-+2H2O=
2Al+2OH-+2H2O= +3H2↑
+3H2↑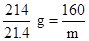 m="16" g
m="16" g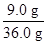 ×100%=25%。
×100%=25%。

科目:高中化学 来源:不详 题型:填空题
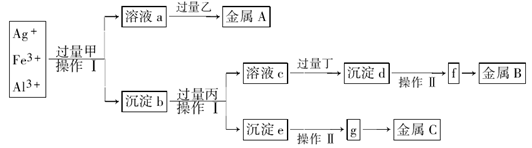
| A.丙是NaOH,丁是稀H2SO4 |
| B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来 |
| C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次 |
| D.g是氧化物,金属c采用电解法获得 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.80mL | B.128mL | C.40mL | D.72mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
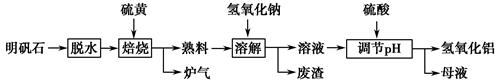
 Al2(SO4)3+
Al2(SO4)3+ S
S
 Al2O3+
Al2O3+ ________↑。
________↑。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
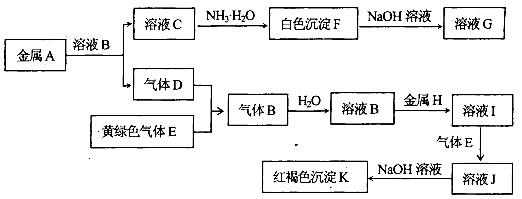
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
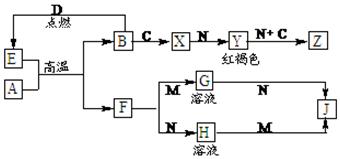
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 测定生成气体的体积
测定生成气体的体积 测定剩余固体的质量
测定剩余固体的质量| A.溶液A和B均可以是盐酸 |
| B.溶液A和B均可以是NaOH溶液 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com