
【题目】已知:常阻下,Ksp.(ZnS)=1.6×10—24;pM=—lgc(M2+)(MI2+为Cu2+或Zn2+)。常温下,向10 mL 0.10 mol/L CuCl2溶液中滴加0.10 mol/L Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )
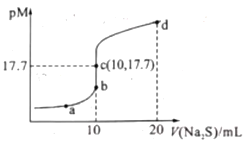
A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl—)>c(S2—)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向b方向移动
【答案】B
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中有关守恒分析解答此题。
A.该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+)·c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4=100.6×10-36,由于1<100.6<10,则Ksp(CuS)的数量级为10-36,故A正确;
B.a点溶液中所含有的溶质为NaCl和Na2S,则根据物料守恒可知,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]+c(Cl—),故B错误;
C.d点时溶质为NaCl和Na2S,n(Na+)=0.1mol/L×0.02L×2=0.004mol,n(Cl-)=0.1mol/L×0.01L×2=0.002mol,即c(Na+)>c(Cl-),Na2S是弱酸强碱盐,水解使溶液显碱性,即c(S2-)>c(OH-)>c(H+),所以c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+),故C正确;
D.已知Ksp(CuS)=10-35.4、Ksp(ZnS)=1.6×10—24,则若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,滴加Na2S溶液10mL时恰好完全反应,此时溶液中c(Zn2+)>c(Cu2+),即PM(Cu2+)>PMc(Zn2+),反应终点c向b方向移动,故D正确;
故答案为B。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】已知:ZnS呈白色,CuS呈黑色;常温下,Ksp(ZnS)=3.0×10-25,Ksp(CuS)=1.0×10-36;pM=-lgc(M2+)。常温下,向10.0mL0.20molL-1ZnCl2溶液中逐滴滴加0.10molL-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法不正确的是( )
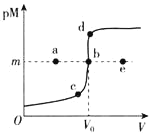
A.V0=20.0mL,m=12.5-![]() lg3
lg3
B.相同实验条件下,若用10.0mL0.20molL-1CuCl2溶液代替上述ZnCl2溶液,则反应终点b向d方向移动
C.若c(ZnCl2)=0.10molL-1,则反应终点可能为e点
D.向b点浊液中加入0.002molCuCl2固体,白色沉淀变黑色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 为中学常见单质,其中一种为金属;通常情况下,A 为固体,B 为液体,C 为气体。D、 E、F、G、H、X 均为化合物,其中 X 是一种无氧强酸、E 为黑色固体,H 在常温下为液体。它们之间的 转化关系如图所示(其中某些反应条件和部分反应物已略去)。

(1)写出化学式:A____________、D__________、E__________、X________。
(2) 在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3) 反应⑥的离子方程式为__________。
(4)反应⑦的化学方程式为__________,该反应中每消耗 0.3molA,可转移电子__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,用0.1molL-1Na2S溶液分别滴定10mL0.1molL-1CuCl2溶液以及10mL0.1molL-1ZnCl2溶液,溶液中-lgc(M2+)(M2+代表Zn2+或Cu2+)与Na2S溶液体积(V)的关系如图所示, b、c分别为滴定终点。下列有关说法错误的是[已知相同温度下:Ksp(CuS)<Ksp(ZnS)]( )
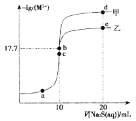
A.a点溶液中Cu2+、Zn2+的浓度相等
B.b、d两点中,水的电离程度d点大
C.曲线乙代表Na2S溶液滴定CuCl2溶液
D.可用ZnS固体除去ZnCl2溶液中的少量Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下两种难溶性盐的沉淀溶解平衡曲线如图所示,图中X2-表示CO32-、SO42-,且MSO4不溶于酸,下列有关说法错误的是( )
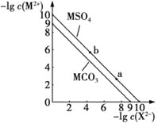
A.MSO4的饱和溶液中c(M2+)=1×10-5molL-1
B.MCO3(s)+SO42-(aq)![]() MSO4(s)+CO32-(aq)的平衡常数K为10
MSO4(s)+CO32-(aq)的平衡常数K为10
C.用盐酸和浓Na2CO3溶液有可能将MSO4转化为MCl2
D.向a点含MSO4的分散系中加入M(NO3)2固体后,体系有可能转化为b点的分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)物质E的结构式为 __________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为
______________。
(5)在一定温度下,有甲、乙两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度 ②适当增大压强
③不断分离出产物C ④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,
则![]() ________
________![]() (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两种元素原子最外层电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它电子层数的2倍,A和C可以形成化合物CA3,B与D的原子序数之比为3∶4。请回答:
(1)化合物CA3的化学式是__________。
(2)写出A和C化合生成CA3反应的平衡常数表达式_________。在一定条件下要使该反应平衡向右移动,可采取的措施有________。
A 缩小反应容器容积 B 增大反应容器容积
C 使用合适的催化剂 D 及时分离出生成物
(3)由四种元素中的三种元素组成的物质甲属于盐类,其水溶液呈酸性,请用离子方程式表示其呈酸性的原因__________,若用pH试纸测定0.1 mol/L的甲溶液的pH,实验操作是__________
(4)乙和丙为含有上述四种元素的常见无机盐,二者均既可与盐酸又可与烧碱溶液反应。则乙和丙的化学式为乙:___________;丙__________。
(5)写出乙溶液与硫酸氢钠溶液反应的离子方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com