
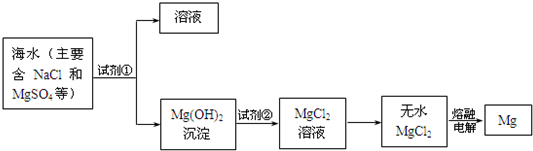
分析 (1)利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂;
(2)分离固体和液体用过滤,利用溶解性的差异来分析;
(3)根据框图从氢氧化镁到氯化镁的反应分析;
(4)根据题目中提供的反应物和生成物解答;
(5)海水中镁的含量为1.10mg•L-1,依据镁元素守恒计算硫酸镁含量,依据镁元素质量和海水中镁的含量计算得到海水的体积.
解答 解:(1)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择NaOH,为了使镁离子完全转化,加入试剂①的量应过量,
故答案为:NaOH溶液;过量;
(2)过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,所以分离得到Mg(OH)2沉淀的方法是过滤,故答案为:过滤;
(3)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:盐酸;
(4)氯化镁电解为分解反应,产物为镁和氯气,故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(5)海水中镁的含量为1.10mg•L-1,假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为=$\frac{1.10}{24}$×120mg/L=5.50mg/L,若某工厂每天生产1.00t镁,则每天需要海水的体积为=$\frac{1000000000mg}{1.1mg/L}$=9.09×108,
故答案为:5.50;9.09×108.
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2 中有4 NA个离子 | |
| B. | 常温常压下,11.2L氧气所含的原子数为NA | |
| C. | 1L 1mol/L CH3COONa溶液中含NA个CH3COO-离子 | |
| D. | 42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-═2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-═2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| B. | 将8.0gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为0.2mol/L | |
| C. | 阿伏加德罗常数个H2O分子在标准状况下的体积是22.4L | |
| D. | 在标准状况下,20mLNH3与60mLO2所含的分子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: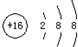 | B. | CO2的结构式:O=C=O | ||
| C. | 醋酸的分子式:CH3COOH | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com