
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:分析 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中加入盐酸时,0-10mL时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,白色沉淀为Mg(OH)2,根据Mg元素守恒:n(MgCl2)=n[Mg(OH)2];
加入盐酸10-20mL,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大时,溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,根据离子方程计算n[Al(OH)3],再根据Al元素守恒计算n(AlCl3);P点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH),沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl),再根据m=nM计算各物质的质量;进而计算P点加入盐酸的体积.
解答 解:将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中加入盐酸时,0-10mL时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,白色沉淀为Mg(OH)2,加入盐酸10-20mL,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大时,溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,加入20-PmL盐酸,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,溶液中的溶质是氯化铝、氯化镁和氯化钠,
(1)10-20mL时,发生反应:H2O+AlO2-+H+=Al(OH)3↓,消耗盐酸体积为20mL-10mL=10mL=0.01L,故n[Al(OH)3]=n(H+)=0.01L×0.5mol/L=0.005mol,根据Al元素守恒:n(AlCl3)=n[Al(OH)3]=0.005mol,则m(AlCl3)=0.005mol×133.5g/mol=0.6675g;
根据Mg元素守恒:n(MgCl2)=n[Mg(OH)2]=$\frac{0.58g}{58g/mol}$=0.01mol;
P点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH),沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.005mol×3+0.02L×0.5mol/L=0.045mol,则m(NaOH)=0.045mol×40g/mol=1.8g;
答:混合物中NaOH的质量为1.8g,AlCl3的质量为0.6675g;
(2)P点溶液中溶质为NaCl、MgCl2、AlCl3,加入盐酸相当于恰好与原混合物中NaOH反应,二者恰好反应时:n(HCl)=n(NaOH)=0.045mol,则V(HCl)=$\frac{0.045mol}{0.5mol/L}$=0.09L=90mL,
答:P点时加入HCl的体积90mL.
点评 本题以化学反应图象形式考查混合物计算,明确各解得发生的反应是关键,综合考查学生分析、计算能力,注意利用守恒进行的解答,难度中等.


科目:高中化学 来源: 题型:解答题

 .
. 2NH3
2NH3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃煤时加入适量石灰石,可减少废气中SO2的含量 | |
| B. | 京津冀、长三角、珠三角雾霾的形成与煤的燃烧、化工厂大量排放含硫、含氮氧化物、颗粒物和汽车排放的尾气等有关 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 使用洁净能源、为汽车安装尾气转化装置、对硝酸厂排放的废气进行碱处理能有效控制氮氧化物对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构造原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸应保存在棕色试剂瓶并置于阴凉处 | |
| B. | 氢氟酸不能装在玻璃瓶,应装在塑料瓶中 | |
| C. | NaOH溶液用带磨口玻璃瓶塞的试剂瓶保存 | |
| D. | 常温下浓硫酸和浓硝酸可以铁制槽罐车运输 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
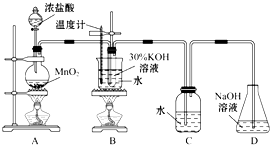 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com