
科目:高中化学 来源:不详 题型:计算题
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.5g |
| 第四次加入10g | 1.0g |
| 第五次加入10g | 0.6g |
| 第六次加入10g | 0.6g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用新制Cu(OH)2悬浊液可鉴别麦芽糖和蔗糖 |
| B.用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化 |
| C.浓H2SO4可使蔗糖变黑,证明浓H2SO4具有脱水性 |
| D.蔗糖溶液中滴加几滴稀H2SO4,水浴加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
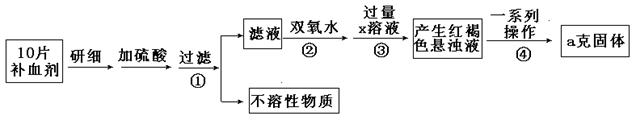
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
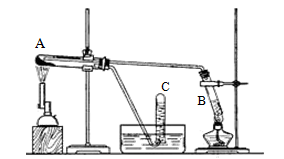
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
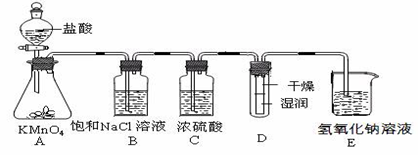
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
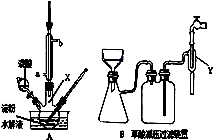
科目:高中化学 来源:不详 题型:实验题
| A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁 |
| B.用酸式滴定管量取18.80mL的碳酸钠溶液 |
| C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低 |
| D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体 |
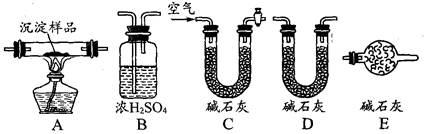
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com