
分析 首先根据阴阳离子共存的进行分析:阴离子CO32-只能和Na+结合为Na2CO3;OH-只能和Ba2+结合为溶于水的Ba(OH)2;故分析可知离子间只能是SO42-和Al3+结合成 Al2(SO4)3;最后剩余Cl- 和HSO-4结合的阳离子Na+、Mg2+;根据反应现象可知A和BC都生成沉淀且沉淀都溶于E溶液,A和D生成沉淀且沉淀溶于酸溶液,分析离子性质判断A为Na2CO3;E为含HSO4-,沉淀可以是Mg2+ Al3+ Ba2+的碳酸盐沉淀;BCD物质中分别含这三种阳离子,依据④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失,说明溶解的沉淀是Al(OH)3;结合离子性质和物质组成判断B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2,符合①②③沉淀形成的性质;①②生成的沉淀溶解于E,说明E中不能含和硫酸根离子、镁离子生成沉淀的离子,则E只能为:NaHSO4(或Mg(HSO4)2),然后结合化学用语来解答.
解答 解:依据阴阳离子共存的分析判断,阴离子CO32- 只能和Na+结合为Na2CO3;OH-只能和 Ba2+结合为溶于水的Ba(OH)2;所以分析可知离子间 SO42-和Al3+ 结合成的物质为Al2(SO4)3;最后剩余Cl- 和HSO-4结合的阳离子Na+、Mg2+;依据反应现象可知A和BCD都生成沉淀且沉淀都溶于酸溶液,分析离子性质判断A为Na2CO3;E为含HSO4-,沉淀可以是Mg2+ Al3+ Ba2+的碳酸盐沉淀;BCD物质中分别含这三种阳离子,依据④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失,说明溶解的沉淀是Al(OH)3;结合离子性质和物质组成判断B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2,符合①②③沉淀形成的性质;①②生成的沉淀溶解于E,说明E中不能含和硫酸根离子、镁离子生成沉淀的离子,则E只能为:NaHSO4(或Mg(HSO4)2);推断出A:Na2CO3 B:Al2(SO4)3 C:MgCl2 D:Ba(OH)2 E:NaHSO4(或Mg(HSO4)2);
(1)由上述分析可知,A为Na2CO3,B为Al2(SO4)3,C为MgCl2 ,
故答案为:Na2CO3;Al2(SO4)3 ;MgCl2;
(2)步骤2中A溶液与C溶液反应的离子方程式为:Mg2++CO32-=MgCO3↓,E:NaHSO4(或Mg(HSO4)2,为强酸硫酸的酸式盐,完全电离出氢离子,沉淀溶于E溶液为碳酸镁和氢离子反应:MgCO3+2H+=Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+=Mg2++CO2↑+H2O;
(3)步骤4中Al2(SO4)3溶液与适量Ba(OH)2溶液反应生成白色沉淀Al(OH)3,氢氧化铝为两性氢氧化物能溶于强碱氢氧化钡,反应为Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(4)含有钠元素的物质焰色反应火焰呈黄色,用洁净的铂丝蘸取E的溶液在无色火焰上进行焰色反应,若火焰呈黄色则为Na+,
故答案为:用铂丝蘸取E的溶液,在酒精灯的火焰上灼烧,若火焰呈黄色则为Na+.
点评 本题考查了离子共存分析判断,注意物质性质的应用,反应现象的判断,同时前后联系,并挖掘出题中隐含信息是解题关键,题目难度中等.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
| X | Y | Z | M |
| R | W |
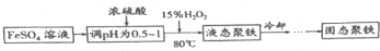
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 160 | B. | 160mol-1 | C. | 1600mol•L-1 | D. | 1600L•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | 物质A的转化率增大了 | ||
| C. | 物质A的质量分数减小了 | D. | 平衡向逆反应方向移动了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O和C4H10O | B. | C3H6O2和C4H8O2 | C. | C4H10和C10H22 | D. | C3H4和C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com