
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.②中由水电离出的c(H+)=1×10-12mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
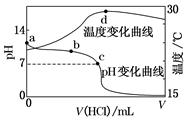
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
B.b点:c(NH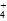 )+c(NH3·H2O)=c(Cl-) )+c(NH3·H2O)=c(Cl-) |
C.c点:c(Cl-)=c(NH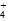 ) ) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸与碱的物质的量一定相等 |
| B.溶液呈现中性 |
| C.酸与碱的物质的量浓度相等 |
| D.酸所能提供的H+与碱所能提供的OH-的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 与上述混合溶液中
与上述混合溶液中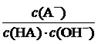 相等
相等查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若pH>7,则一定是c1V1=c2V2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2>c1 |
| D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )| A.c(H+)随着温度的升高而降低 |
| B.35 ℃时c(H+)>c(OH-) |
| C.35 ℃时的水比25 ℃时的水电离程度小 |
| D.水的电离是个吸热过程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2O(g)=H2(g)+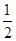 O2(g) ΔH=+242 kJ·mol-1 O2(g) ΔH=+242 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1 |
C.H2(g)+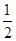 O2(g)=H2O(g) ΔH=+242 kJ·mol-1 O2(g)=H2O(g) ΔH=+242 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com