(2011?双流县模拟)氨基磺酸(H
2NSO
3H)是一元固体强酸,溶于水和液氨,不溶于乙醇.在工业上用作酸性清洗剂、阻燃剂、磺化剂.用尿素[CO(NH
2)
2]和发烟硫酸(溶有SO
3的硫酸)为原料合成氨基磺酸的路线如下:

(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是
氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小
氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小
.
(2)“磺化”步骤中所发生的反应为:
①CO(NH
2)
2(s)+SO
3(g)?H
2NCONHSO
3H(s)△H<0
②H
2NCONHSO
3H+H
2SO
4?2H
2NSO
3H+CO
2↑
“磺化“过程应控制反应温度75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是
温度高,三氧化硫逸出速率快,使反应①转化率降低,反应①平衡向逆向进行
温度高,三氧化硫逸出速率快,使反应①转化率降低,反应①平衡向逆向进行
.
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol?L
-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.080mol?L
-1NaNO
2溶液,当溶液恰好变蓝时,消耗NaNO
2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N
2,NaNO
2的还原产物也为N
2.
①写出氨基磺酸与NaNO
2溶液反应的化学方程式
H2NSO3H+NaNO2=NaHSO4+N2↑+H2O
H2NSO3H+NaNO2=NaHSO4+N2↑+H2O
.
②产品中氨基磺酸的质量分数为
98.0%
98.0%
.
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO
2法偏高,原因是氨基磺酸中混有
硫酸
硫酸
杂质.




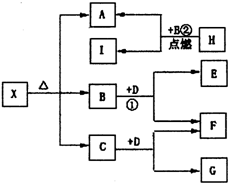 (2011?双流县模拟)如图为一些常见无机物之间的转化关系,已知X是-种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:
(2011?双流县模拟)如图为一些常见无机物之间的转化关系,已知X是-种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题: