
| A. | 福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 | |
| B. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 | |
| C. | 除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 | |
| D. | 为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
分析 A.从同位素的概念的角度分析;
B.电子云是电子在核外运动的概率密度分布的形象化描述;
C.饱和亚硫酸氢钠能与氯化氢反应生成二氧化硫;
D.瓷坩埚的成分是二氧化硅.
解答 解:A.131I与127I的质子数相同而中子数不同,属于同位素,二者最外层电子数相同,化学性质相同,故A正确;
B.电子云是电子在原子核外空间的概率密度分布的形象化描述,故B正确;
C.饱和亚硫酸氢钠能与氯化氢反应生成二氧化硫,与二氧化硫不反应,可以除去二氧化硫中混有的少量氯化氢,故C正确;
D.瓷坩埚的成分是二氧化硅,二氧化硅能与氢氧化钠反应生成硅酸钠,所以不能在瓷坩埚中将氢氧化钠固体熔化后测其导电性,故D错误.
故选D.
点评 本题考查同位素、电子云、除杂等,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 消去反应 | C. | 加成反应 | D. | 加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | C、N、O原子序数依次减小 | D. | P、S、Cl最高正价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,写出HFO的结构式H-O-F.
,写出HFO的结构式H-O-F.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
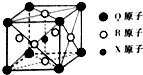 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和.另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题.
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和.另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | ||
| Y | Z |
| A. | W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料 | |
| B. | Z元素的最高价氧化物水化物的酸性强于Y | |
| C. | 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定 | |
| D. | 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com