
| A. | Cl2+H2O═HCl+HClO | B. | 3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 3NO2+H2O═2HNO3+NO |
科目:高中化学 来源: 题型:填空题
| X | Y | ||
| Z | W | Q |
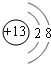 .
.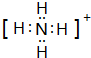 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W |
| A. | 原子半径:Y>Z>X | |
| B. | 气态氢化物的稳定性:W>Z>X | |
| C. | 最高价氧化物对应水化物的酸性:W>Z>Y | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol Cl2和HCl的混合气体所含分子总数为2NA | |
| B. | 101kPa、0℃时,22.4 L H2中氢原子数为NA个 | |
| C. | 标准状况下,2.24 L CCl4含有的碳原子数目为0.1NA | |
| D. | 常温常压下3.2 g O2中含有的氧原子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Fe2+ | C. | Cu2+ | D. | 无减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.23 g NaCl固体 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 分液以后 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | |
| D. | 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
 ,其中所含的化学键类型为离子键和非极性键.
,其中所含的化学键类型为离子键和非极性键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥ | B. | ②⑦ | C. | ①③④ | D. | ⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com