
【题目】锌锰干电池的结构示意图如图:
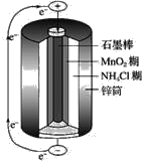
电池总反应式:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+H2O,回答下列问题:
(1)锌锰干电池的负极是__,电极反应式是__。
(2)锌锰干电池的正极是_,电极反应式是__。
(3)锌锰干电池又称一次性电池的原因是__。
(4)锌锰干电池的有缺陷是__,改进的方法是__。
【答案】锌筒 Zn-2e-=Zn2+ 石墨棒 2MnO2+2NH4++2e-=Mn2O3+2NH3↑+H2O 锌锰干电池内部的氧化还原反应是不可逆的,放电之后不能充电,为一次性电池 电量小,容易产生气涨,锌外壳易破损漏液,腐蚀电器设备 加外壳(防腐金属或塑料筒)制成防漏电池,用氢氧化钾代替氯化铵制成碱性锌锰电池
【解析】
(1)原电池工作原理是:负极失电子,发生氧化反应,正极得电子,发生还原反应;负极发生氧化反应失电子,由方程式Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+H2O可知Zn被氧化生成Zn2+,电极反应为Zn-2e-=Zn2+;
(2)正极材料是石墨,正电极反应=电池总反应-负电极反应,2MnO2+2NH+2e-=Mn2O3+2NH3↑+H2O;
(3)锌锰干电池是一次电池,内部的氧化还原反应是不可逆的,放电之后不能充电;
(4)锌锰干电池电量小,而且在放电过程中,正极产生气体容易发生气涨;负极锌外壳会逐渐变薄漏液,会导致电器设备的腐蚀。
(1)由锌锰干电池的总反应式Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+H2O可知,锌的化合价升高,失去电子发生氧化反应,锌为负极,电极反应式为:Zn-2e-=Zn2+,
故答案为:锌筒;Zn-2e-=Zn2+;
(2)二氧化锰的化合价降低,在正极上得到电子发生还原反应,正极材料为石墨棒。锌锰干电池的总反应式与负极反应式(Zn-2e-=Zn2+)相减,可得其正极反应式2MnO2+2NH+2e-=Mn2O3+2NH3↑+H2O,
故答案为:石墨棒;2MnO2+2NH4++2e-=Mn2O3+2NH3↑+H2O;
(3)根据电池总反应式:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+H2O,锌锰干电池是一次电池,内部的氧化还原反应是不可逆的,放电之后不能充电,
故答案为:锌锰干电池内部的氧化还原反应是不可逆的,放电之后不能充电,为一次性电池;
(4)锌锰干电池电量小,而且在放电过程中,正极产生气体容易发生气涨;负极锌外壳会逐渐变薄漏液,会导致电器设备的腐蚀。改进方法:在外壳套上防腐金属筒或塑料筒制成防漏电池;将电池内的电解质氯化铵换成湿的氢氧化钾,并在构造上进行改进,制成碱性锌锰电池,
故答案为:电量小,容易产生气涨,锌外壳易破损漏液,腐蚀电器设备;加外壳(防腐金属或塑料筒)制成防漏电池,用氢氧化钾代替氯化铵制成碱性锌锰电池。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略)。其中,A是一种气态烃,在标准状况下的密度是1.25 g·L-1,其产量是衡量一个国家石油化工发展水平的标志;C的分子式为C2H4O2;B和C在浓硫酸和加热的条件下发生反应,生成的有机物D有特殊的香味。
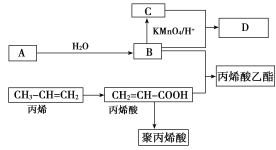
试回答下列问题:
(1)A的分子式为________,丙烯酸分子结构中所含的官能团名称是________,丙烯分子中最多有________个原子共平面。
(2)丙烯酸乙酯可能发生的反应类型有________。
①加成反应 ②取代反应 ③加聚反应 ④中和反应
A.①③ B.①②③
C.①③④ D.①②③④
(3)写出聚丙烯酸的结构简式________。
(4)写出丙烯酸与B反应的化学方程式_________________________________________________。
(5)下列有关说法正确的是________(填编号)。
A.D与丙烯酸乙酯互为同系物
B.B→C的转化是氧化反应
C.可以用酸性KMnO4溶液鉴别A和丙烯酸
D.蒸馏能分离B和C的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.环戊二烯(![]() )分子中所有原子共平面
)分子中所有原子共平面
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.NO![]() 离子中心原子上的孤电子对数是0,立体构型为平面三角形
离子中心原子上的孤电子对数是0,立体构型为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是常用的消毒剂,易溶于水、易挥发、见光或受热易分解。制备原理为:H2O2+CH3COOH![]() CH3COOOH+H2O △H<0,制得的过氧乙酸(含少量H2O2)含量测定流程如下,下列说法不正确的是( )
CH3COOOH+H2O △H<0,制得的过氧乙酸(含少量H2O2)含量测定流程如下,下列说法不正确的是( )
![]()
A.应在密闭、低温、避光条件下保存过氧乙酸
B.在常压条件下采用蒸馏操作将过氧乙酸分离出来
C.溶液由无色变为浅红色且30s内不变色,说明H2O2已除尽
D.加过量硫酸亚铁溶液目的是还原CH3COOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O,下列说法正确的是( )
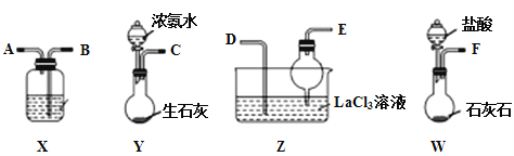
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
D.实验开始时应先打开Y中分液漏斗的旋转活塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是( )
A.升高温度,该反应的平衡常数减小
B.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
C.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D.第二阶段,Ni(CO)4分解率较低
查看答案和解析>>
科目:高中化学 来源: 题型:
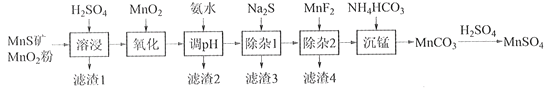
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氯芬酸钠(G)是常用的抗炎镇痛药,一种合成路线如图(-Ph为苯基):
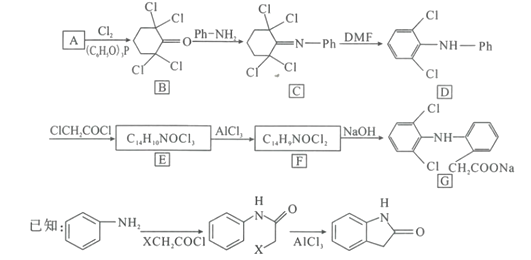
回答下列问题:
(1)9.8gA完全燃烧生成26.4gCO2和9.0gH2O,且A的核磁共振氢谱中有3组峰,峰面积之比为1:2:2,则A的结构简式是___。
(2)B中的官能团名称是___。
(3)E到F的反应类型是___。
(4)写出F到G的反应方程式___。
(5)能发生银镜反应且为环状结构的A的同分异构体多达14种,写出其中只含一条侧链且侧链上的一氯代物为2种的结构简式___(不考虑立体异构)。
(6)设计由2—丙醇和对苯二胺(![]() )制备
)制备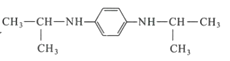 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com