
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____。
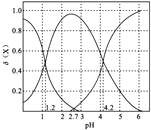
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A的电离平衡常数K1=____。
(3)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.l00 mol·L-1的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化)
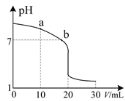
①a点所示的溶液中c(NH3·H2O)____c(Cl-)。
②b点所示的溶液中c(Cl-)____c(NH![]() )。
)。
③pH =10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(4)常温下,要将ZnSO4溶液中的Zn2+沉淀完全(Zn2+的浓度小于10-5 mol·L-1),应控制溶液的pH____。(已知25℃时,Ksp[Zn(OH)2] =1.0×l0-17)
【答案】NaF CO![]() +H2S=HS-+HCO
+H2S=HS-+HCO![]() 10-1.2 < = 10-6 >8
10-1.2 < = 10-6 >8
【解析】
(1)图表中数据分析可知酸性HF>H2CO3>H2S>HCO3->HS-,对应盐的水解程度F-<HCO3-<HS-<CO32-<S2-;
①常温下,PH相同的三种溶液NaF、Na2CO3、Na2S,水解程度越大的溶液浓度越小;
②将过量H2S通入Na2CO3溶液,由强酸制强酸可知反应生成NaHS和NaHCO3;
(2)二元弱酸H2A在水溶液中分步水解,则随着溶液pH的增大,溶液中H2A的浓度逐渐减小,HA-的浓度先增大后减小,则A2-的浓度逐渐增大,故图中三曲线分别是 ;
;
(3)①a点加入了10mL盐酸,反应后的溶液中含有等浓度的氨水和氯化铵,NH3H2O的电离程度大于铵根离子的水解,溶液显示碱性;
②b点溶液pH=7,结合溶液中的电荷守恒式分析;
③常温下,pH=10的氨水溶液中,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-10mol/L;pH=4的NH4C1溶液中水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-4mol/L;
(4)依据Ksp[Zn(OH)2] =1.0×l0-17=c(Zn2+)×c2(OH-)计算。
(1)图表中数据分析可知酸性HF>H2CO3>H2S>HCO3->HS-,对应盐的水解程度F-<HCO3-<HS-<CO32-<S2-;
①常温下,PH相同的三种溶液NaF、Na2CO3、Na2S,水解程度越大的溶液浓度越小,则物质的量浓度由大到小的顺序为NaF>Na2CO3>Na2S,即NaF的物质的量浓度最大;
②将过量H2S通入Na2CO3溶液,由强酸制强酸可知反应生成NaHS和NaHCO3,则发生反应的离子方程式为CO![]() +H2S=HS-+HCO
+H2S=HS-+HCO![]() ;
;
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化为 ,当pH=1.2,即c(H+)=10-1.2mol/L时,溶液中c(H2A)=c(HA-),此时H2A的电离平衡常数K1=
,当pH=1.2,即c(H+)=10-1.2mol/L时,溶液中c(H2A)=c(HA-),此时H2A的电离平衡常数K1= =10-1.2;
=10-1.2;
(3)①点加入的盐酸体积为氨水体积的![]() ,等浓度的两溶液反应后,混合液中含有等浓度的氨水和氯化铵,由于NH3H2O的电离程度大于铵根离子的水解程度,则溶液显示碱性,则溶液中c(NH3·H2O)<c(Cl-);
,等浓度的两溶液反应后,混合液中含有等浓度的氨水和氯化铵,由于NH3H2O的电离程度大于铵根离子的水解程度,则溶液显示碱性,则溶液中c(NH3·H2O)<c(Cl-);
②b点时溶液pH=7,则c(H+)=c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(C1-)+c(OH-),可知c(Cl- )=c(NH4+);
③常温下,pH=10的氨水溶液中,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-10mol/L;pH=4的NH4C1溶液中水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-4mol/L,pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为=![]() =10-6;
=10-6;
(4)常温下,Ksp[Zn(OH)2] =1.0×l0-17=c(Zn2+)×c2(OH-),其中c(Zn2+)=10-5 mol·L-1,则c (OH-)=![]() mol·L-1= 10-6mol·L-1,此时溶液pH=8,即应控制溶液的pH>8,可使Zn2+沉淀完全。
mol·L-1= 10-6mol·L-1,此时溶液pH=8,即应控制溶液的pH>8,可使Zn2+沉淀完全。


科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
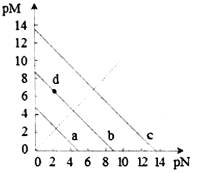
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=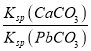
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
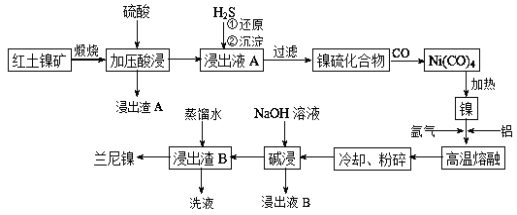
(1)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________;
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,写出有关镍元素的加压酸浸的化学反应方程式______________________;
(3)向浸出液A中通入H2S气体,反应的离子方程式是____________________;
(4)“高温熔融”时能否将通入氩气换为CO并说明原因_____________________;
(5)“碱浸”的目的是使镍铝合金产生多孔结构,从而增强对氢气的强吸附性,此过程
中发生反应的离子方程式为___________________。浸出反应所用的NaOH溶液的浓度要大,若NaOH溶液较稀时,则会产生少量的Al(OH)3沉淀而阻止浸出反应的持续进行,请用化学反应原理加以解释:________________________。
(6)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→________________________。(示例:CuOCu2+Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶有气泡从溶液中冒出
B.黄绿色的氯水光照后颜色变浅
C.FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
D.2NO2(g)![]() N2O4(g)平衡体系中,加压缩小体积后颜色加深
N2O4(g)平衡体系中,加压缩小体积后颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨气反应的能量变化如图,下列说法正确的是

A.相同条件下,催化剂b的效果更好
B.使用催化剂,合成氨反应放出的热量减少
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示且与对应的叙述不相符的是( )
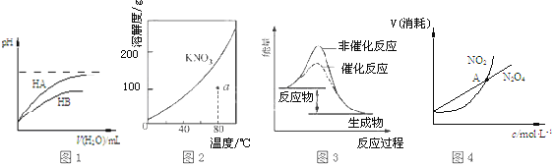
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
B.图2表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
C.图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
请回答:(1)表中V1=___________,V2=___________。
(2)根据上表中的实验数据,可以得到的结论是_____________________________。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________________________。
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。(忽略反应过程中温度变化)
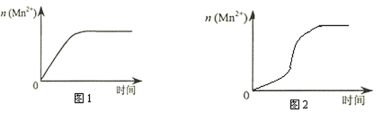
①该小组同学提出的假设是_______________________________________。
②请你帮助该小组同学完成实验方案。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | A | t |
表中加入的固体A是_______________。(写化学式)
③若该小组同学提出的假设成立,应观察到的现象是____________
(5)工业上可用电解K2MnO4溶液的方法制取KMnO4,则电解时,阳极发生的电极反应式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是

A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com