
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
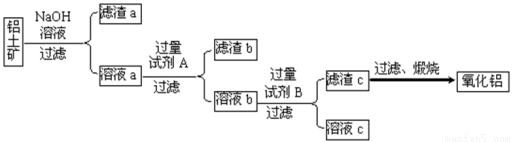
(1)试剂A是 ;
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式 。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: Al2O3 + C+ N2  AlN+ CO(配平)
AlN+ CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
Ⅰ、(1)盐酸(硫酸或硝酸);(2分) (2)Al2O3中含有SiO2杂质;(2分)
Ⅱ、(3)2Al2O3(熔融)  4Al + 3O2↑(3分)
4Al + 3O2↑(3分)
Ⅲ、(4) 1 Al2O3 + 3 C + 1 N2 === 2 AlN + 3 CO (2分) (5) AB(2分)
【解析】
试题分析:氧化铝、二氧化硅均能与氢氧化钠溶液反应生成偏铝酸钠和硅酸钠,氧化铁不反应,则滤渣a是氧化铁。要从偏铝酸钠和硅酸钠的混合溶液中得到氢氧化铝,则需要加入过量的盐酸生成氯化铝和硅酸沉淀,即滤渣b是硅酸,溶液b中含有氯化铝,通入足量的氨气即生成氢氧化铝沉淀,氢氧化铝分解得到氧化铝,则
(1)由以上分析可知试剂A是盐酸;
(2)若向溶液a中通入过量的CO2,则生成氢氧化铝和硅酸沉淀,不溶物煅烧后得到的氧化铝中将含有二氧化硅杂质。
(3)电解熔融的氧化铝生成铝和氧气,反应的化学方程式为2Al2O3(熔融)  4Al + 3O2↑。
4Al + 3O2↑。
(4)根据方程式可知,在反应中碳元素的化合价从0价升高到+2价,失去2个电子。氮元素的化合价从0价降低到-3价,得到3个电子,则根据电子得失守恒和原子守恒可知配平后的化学方程式为Al2O3 +3C + N2 =2AlN +3CO。
(5)方法①和方法②相比较,需要较多能量,且生成的固体易残留在AlN中,反应①AlN是还原产物,反应②没有发生氧化还原反应,故答案为:AB。
考点:考查从铝土矿中制备氧化铝的流程图分析、铝的冶炼、氧化还原反应应用等


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为 ( )
A. 1︰1 B. 2︰1 C. 1︰2 D. 2︰3
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪第一中学高三9月摸底考试化学试卷(解析版) 题型:填空题
(13分)近年来我国的航天事业取得了巨大的成就,在航天发射时,常用肼(N2H4)及其衍生物作火箭推进剂。
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每克肼充分反应后生成氮气和气态水放出热量为a KJ,试写出该反应的热化学方程式 ;
(2)在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。在蒸馏过程中需要的仪器有酒精灯、锥形瓶、冷凝管、牛角管(接液管)、蒸馏烧瓶,除上述必需的仪器外,还缺少的玻璃仪器是 ;
(3)肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。
(4)磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO; 假设2. 黑色粉末是Fe3O4;
假设3. 。
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若溶液显蓝色,则假设1成立。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向②所得溶液加入足量铁粉,若有红色固体析出的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若假设3成立,则产生红褐色沉淀,同时溶液呈深蓝色。
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪第一中学高三9月摸底考试化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数,下列叙述错误的是
A.标准状况下,11.2 L氦气中含有0.5 NA原子
B.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0. 2 NA
C.常温常压下,46g NO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数NA个
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪第一中学高三9月摸底考试化学试卷(解析版) 题型:选择题
某合作学习小组讨论辨析以下说法:①粗盐和碱石灰都是混合物;②天然气和水煤气都是可再生资源;③冰和水混合物不是混合物而是纯净物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和烧碱都是碱;⑦豆浆和雾都是胶体。上述说法正确的是
A.①③④⑦ B.①②⑤⑥ C.③⑤⑥⑦ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
已知:N2(g)+3H2(g) 2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| H2(g) | N2(g) | NH3(g) |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,

下列说法正确的是
A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期考试化学试卷(解析版) 题型:选择题
下列分子或离子在指定条件的分散系中能大量共存的是
A.Ca(NO3) 2溶液中: Fe2+、H+、Cl—、SO42—;
B.使pH试纸变蓝的溶液中:K+、NH4+、S-、SO32-;
C.水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、HCO3—、CH3COO-[;
D.透明的强酸性溶液中: Al3+、Fe3+、Cl-、SO42
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:选择题
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的
A.分子数和气体质量均不同
B.分子数和电子数均相同
C.质子数和中子数均相同
D.分子数、原子数和中子数均相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com