
 8SO2+2Fe2O3,该反应的氧化产物是 ,当生成8 mol SO2时转移电子的物质的量为 。
8SO2+2Fe2O3,该反应的氧化产物是 ,当生成8 mol SO2时转移电子的物质的量为 。 2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1 α2(填“大于”、“等于”或“小于”)。
2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1 α2(填“大于”、“等于”或“小于”)。 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.明矾净水与液氯净水的原理相同 |
| B.镀层破损后,镀铜铁板比镀锌铁板更耐腐蚀 |
| C.必要时向空中播撒碘化银微粒,可达到人工降雨的目的 |
| D.碳酸钠可用于焙制糕点,也可用于治疗胃酸过多症 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
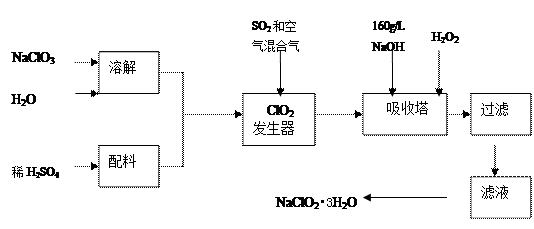

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
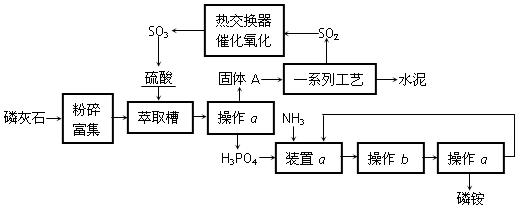
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀H2SO4 |
| C.碘水、淀粉溶液 | D.氨水、酚酞试液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
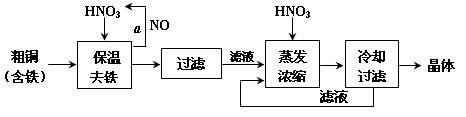
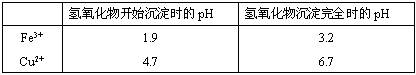
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g),其
2NH3(g),其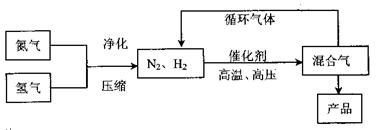
 2NH3(g)的△H= ;
2NH3(g)的△H= ;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
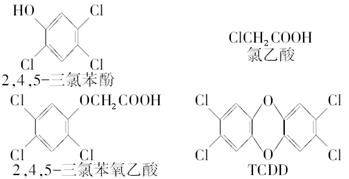
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(1)(3)(5) | B.(2)(3)(4) | C.(1)(3)(4) | D.(1)(3)(4)(5) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com