


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
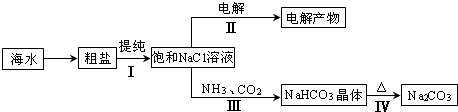
| ||
| ||
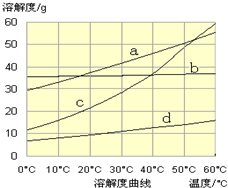
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A. 分别和盐酸反应时,混合物消耗的盐酸量大
B. 分别与足量盐酸反应时,混合物放出的CO2多
C. 分别配制等体积的溶液混合物的物质的量浓度大
D. 分别配制等体积溶液,混合物的c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
A.分别和盐酸反应时,混合物消耗的盐酸量大
B.分别与足量盐酸反应时,混合物放出的CO2多
C.分别配制等体积的溶液,混合物的物质的量浓度大
D.分别配制等体积溶液,混合物的c(Na+)大
查看答案和解析>>
科目:高中化学 来源: 题型:
A.分别和盐酸反应时,混合物消耗的盐酸量大
B.分别与足量盐酸反应时,混合物放出的CO2多
C.分别配制等体积的溶液,混合物的物质的量浓度大
D.分别配制等体积溶液,混合物的c(Na+)大
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴(8分)甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量,所得固体是 (填化学式);写出该反应的离子方程式________________________ __。
 乙组:气体分析法
乙组:气体分析法
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,(将选项填入空格中)
A.氢氧化钠溶液 B.饱和氯化钠溶液 C.饱和碳酸氢钠溶液
选用该溶液后实验结果还是不准确,原因是_________________________________。
⑵(5分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:
① Zn+盐酸;② Na+水;③ Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下图(原实验)所示的装置图,请回答下列问题:
①写出Al和NaOH溶液反应的化学方程式 。
② 实验小组在点燃用此装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是 。
③ 实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。

在改进后的实验中H2的生成速率减慢。原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com