
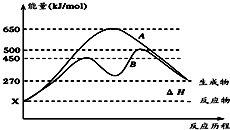
 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:

 和
和
 和
和
 (环戊烷)
(环戊烷)
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中性溶液的pH都相等 |
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 |
| C、127I和131I2互为同位素 |
| D、△H<0,△S<0的化学反应不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
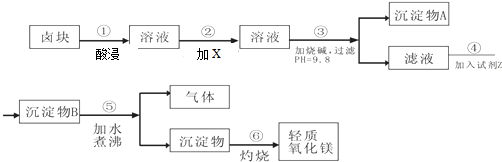
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
2- 3 |
2- 4 |
2- 3 |
2- 4 |
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
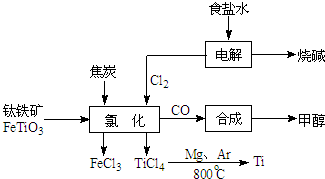
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
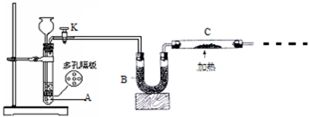 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com