

| 0.02mol/L |
| 0.03mol/L |
| [N2O4] |
| [NO2]2 |
| 0.01mol/L |
| (0.01mol/L)2 |


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源:2011-2012学年广东省中山一中高二下学期第一次段考化学试卷(带解析) 题型:填空题
(12分)在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
| 温度/℃ | 700 | 800 | 850 | 1000 | 1200 |
| 平衡常数K | 2.6 | 1.7 | 1 | 0.9 | 0.6 |

| | A | B | C | D | E |
| n(CO2)[ | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
查看答案和解析>>
科目:高中化学 来源:2013届广东省山一高二下学期第一次段考化学试卷(解析版) 题型:填空题
(12分)在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
|
温度/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
平衡常数K |
2.6 |
1.7 |
1 |
0.9 |
0.6 |
(1)该反应的△H 0。(填“>”、“=”或“<”)。若到达平衡后升高温度,则CO2的转化率将 ,正反应速率 (填“增大”、“减小”或“不变”)。
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。

(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
|
|
A |
B |
C |
D |
E |
|
n(CO2)[ |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
0.5 |
1 |
(4) 850℃时,在1L的密闭容器中分别充入2mol的CO2和H2,计算反应到达平衡时CO的物质的量浓度。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
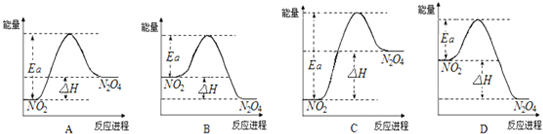
查看答案和解析>>
科目:高中化学 来源:广东省期中题 题型:填空题
 CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:

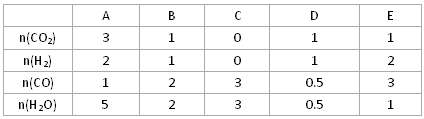
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com