
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )

A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,下列各组热化学方程式中,△H1<△H2是
A.C(s)+![]() O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
B.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
D.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列工业产品的生产设计中原子利用率没有达到100%的是
A.合成甲醇:CO + 2H2![]() CH3OH
CH3OH
B.合成乙醛:2CH2=CH2 + O2![]() 2CH3CHO
2CH3CHO
C.合成全降解聚碳酸酯塑料:![]()
D.合成有机玻璃单体-甲基丙烯酸甲酯:
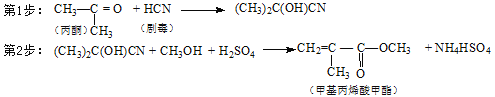
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于炔烃的下列描述正确的是( )
A.分子里含有碳碳三键的不饱和链烃叫炔烃
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使高锰酸钾酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为___________。
(2)0.1 mol 烷烃E完全燃烧,消耗标准状况下的O211.2 L,其分子式为___________。
(3)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为____________。
(4)某有机物的结构表达式为![]() ,其名称是_______________。
,其名称是_______________。
(5)萘的结构式为![]() ,其分子式为 ,它的二氯代物又有 种。
,其分子式为 ,它的二氯代物又有 种。
(6)立方烷![]() 其分子式为 ,它的六氯代物有 种。
其分子式为 ,它的六氯代物有 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是

A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉KI试纸未变蓝说明SO2的还原性弱于I2
D.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质①HCl②CO2③H2O④H2⑤NaHSO4⑥Cl2⑦NaF⑧CH4⑨CaO⑩MgCl2
(1)属于离子化合物的是_______,只含共价键的是______,既含有离子键又有共价键的是______。
(2)属于电解质的是__________,属于非电解质的是___________。
(3)将NaHSO4熔化,破坏了NaHSO4中的__________键,写出其电离方程式_____________。将NaHSO4溶于水,破坏了NaHSO4中的_________键,写出其电离方程式_____________。
(4)分别用电子式表示氯化镁、氯气的形成过程:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
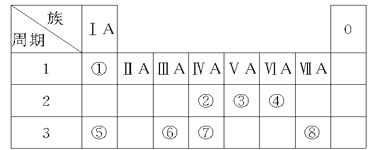
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)_______。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________。
(3)①、④、⑤三种元素可形成既含离子键又含共价键的化合物,写出该化合物的电子式________。
(4)②的氧化物的结构式_________;比较②、⑦的氧化物的熔点(填化学式):
______>_______,原因是___________________________________________。
(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。
①Be(OH)2与Mg(OH)2可用__________鉴别(填名称)。
②写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com