
长效碳酸氢铵是我国自主开发的一种新型化肥,工业生产碳酸氢铵的工艺流程如下:
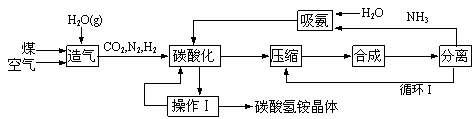 |
根据题意回答下列问题:
(1)操作Ⅰ有多步组成,包括冷却、过滤、洗涤、干燥;实验室进行过滤操作用到的玻璃仪器有___________,实验室进行该洗涤操作时宜用酒精代替水洗涤,理由是____________;
(2)分离工序是将氨从反应混合物中分离出来,其分离原理利用了氨的_________性质,设计循环Ⅰ的目的是_______________________________________;
(3)造气工序包括脱硫过程,目的是除去气体中的SO2等气体,实验室进行此操作可选用的试剂是________(填写编号);
A.NaHCO3溶液 B. NaOH溶液 C.Ca(OH)2溶液 D.Na2SO3溶液
(4)实验室实现吸氨过程可以是下列装置中的_____________(填写编号);

A. B. C. D.
(5)索尔维创建氨碱法不久后的1898年, 施莱信(Schlosing)就提出用碳酸氢铵固体与氯化钠饱和溶液作用生成碳酸氢钠再加热制纯碱的方法。写出生成碳酸氢钠的化学方程式:______________________________________; 为了进一步提纯碳酸氢钠晶体,可采用的方法有:________(填写编号);
A. 加热灼烧法 B. 重结晶法 C.酸中和法 D. 碱沉淀法
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )
A.+2 B.+3 C.+4 D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,发生CO + NO2  CO2 + NO 的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是
CO2 + NO 的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是
A.正反应为吸热反应 B.正反应为放热反应
C.降温后CO的浓度增大 D.降温后各物质的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
水是地球表面上普遍存在的化合物,我们可以用我们学习的物质结构与性质的有关知识去认识它。
(1)水的组成元素为氢和氧。氧的基态原子的价电子排布图为______________,氧的第一电离能在同周期元素中由大到小排第______位。
(2)根据杂化轨道理论,水分子中的氧原子采取的杂化形式是_______;根据价层电子对互斥理论,水分子的VSEPR模型名称为______________;根据等电子体原理,写出水合氢离子的一个等电子体(写结构式)_____________。
(3)水分子可以形成许多水合物。
①水分子可以作配体和铜离子形成水合铜离子[Cu(H2O)4]2+,1mol水合铜离子中含有σ键数目为_________。
②图1是水合盐酸晶体H5O2+·Cl-中H5O2+离子的结构。
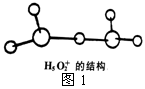
在该离子中,存在的作用力有______________。
a.配位键 b.极性键 c.非极性键 d.离子键
e.金属键 f.氢键 g.范德华力 h.π键 i.σ键
(4)韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。请从结构上解释生成暖冰的原因_________________________________。
(5)最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。图2为冰的一种骨架形式,依此为单位向空间延伸。
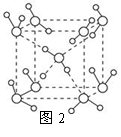
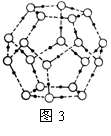
①该冰中的每个水分子有_________个氢键;
②冰融化后,在液态水中,水分子之间仍保留有大量氢键将水分子联系在一起,分子间除了无规则的分布及冰结构碎片以外,一般认为还会有大量呈动态平衡的、不完整的多面体的连接方式。右图的五角十二面体是冰熔化形成的理想多面体结构。假设图3中的冰熔化后的液态水全部形成右图的五角十二面体,且该多面体之间无氢键,则该冰熔化过程中氢键被破坏的百分比为________。
③如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰连接类似?____________;
④已知O-H…O距离为295pm,列式计算此种冰晶体的密度 g/cm3。(已知2952=8.70×104,2953=2.57×107,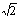 =1.41,
=1.41,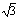 =1.73)
=1.73)
查看答案和解析>>
科目:高中化学 来源: 题型:
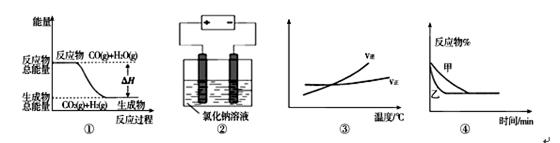
关于下列四个图象的说法中正确的是 ( )
A.图①表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0
CO2(g)+H2(g)”中的△H大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的△H小于0
2AB3(g)”的△H小于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 d>c>b>a
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
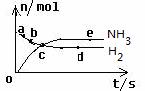
合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的 N2(g)+3H2(g) 2NH3(g),在673K 30MPa下,n(NH3)
2NH3(g),在673K 30MPa下,n(NH3)
和n(H2)随时间变化的关系如右图所示。下列叙述正确的是
A.a点的正反应速率比b点的小
B.d点和e点n(N2)不相等
C.c点反应达平衡
D. d点的正反应速率与e点正反应速率相等
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,实线表示σ键,另外中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部)——三个O原子均等地享有这4个电子。根据等电子体原理,下列分子中与O3分子的结构最相似的是( )
A.SO2 B.CO2 C.H2O D.BeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
向物质的量浓度均为1 mol·L-1的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,下图 [n表示Al(OH)3的物质的量、V表示NaOH溶液的体积]能正确表示这个反应过程的是
( )
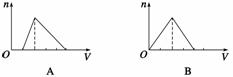
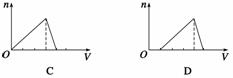
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com