
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | Mg粉 | Al粉 | NaOH溶液,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碘不易溶于水,易溶于四氯化碳;
B.HCl与饱和NaHCO3溶液反应生成CO2;
C.Al粉与NaOH溶液反应,而Mg粉不能;
D.二者均与盐酸反应.
解答 解:A.碘不易溶于水,易溶于四氯化碳,则加四氯化碳、萃取可分离,故A正确;
B.HCl与饱和NaHCO3溶液反应生成CO2,而CO2与饱和NaHCO3溶液不反应,则通过洗气可分离,故B正确;
C.Al粉与NaOH溶液反应,而Mg粉不能,则反应后过滤可分离,故C正确;
D.二者均与盐酸反应,不能除杂,应溶解、过滤分离,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、分离方法为解答的关键,侧重分析与实验能力的考查,注意分离原理及应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 污水中所含离子 | H+、OH- | CN- | Cu2+、Hg2+ |
| 处理方法 | 中和法 | 氧化还原法 | 沉淀法 |
| 物质 | Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| Ksp | 2.2×10-20 | 8.5×10 -45 | 6.3×10 -18 | 3.4×10-28 | 4×10-53 | 8×10-29 |
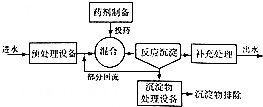
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
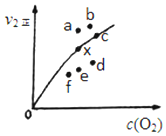 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
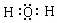 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
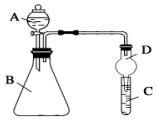 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
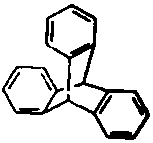
| A. | 三蝶烯是苯的同系物 | |
| B. | 三蝶烯能发生取代反应 | |
| C. | 三蝶烯的一氯代物有6种 | |
| D. | 三蝶烯分子中所有原子可能在同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com