
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO4 | ||
| C. | 该实验表明FeCl3有氧化性 | D. | 反应后溶液酸性增强 |
分析 氯化铁具有氧化性,能与二氧化硫发生氧化还原反应生成硫酸根离子,再与钡离子反应生成硫酸钡沉淀,铁离子被还原为亚铁离子,溶液由由棕黄色变成浅绿色,以此来解答.
解答 解:A.二氧化硫的漂白性是指二氧化硫和水反应生成的亚硫酸与有色物质结合为不稳定的无色物质,此反应中二氧化硫做还原剂,故A错误;
B.二氧化硫被氧化为硫酸,生成的沉淀为硫酸钡,故B正确;
C.反应中溶液由由棕黄色变成浅绿色,三价铁变化为二价铁,该实验表明FeCl3具有氧化性,故C正确;
D.反应后生成硫酸,酸性增强,故D正确.
故选A.
点评 本题考查二氧化硫的性质,为高频考点,侧重于学生的分析能力的考查,明确发生的氧化还原反应是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 氧化还原反应前后元素化合价有升降 | |
| B. | 氧化还原反应前后一定有氧的得失 | |
| C. | 氧化还原反应前后一定有电子转移 | |
| D. | 复分解反应和化合反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8倍 | B. | 12倍 | C. | 24倍 | D. | 64倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为正值 | |
| B. | K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为:NO+SO3?NO2+SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
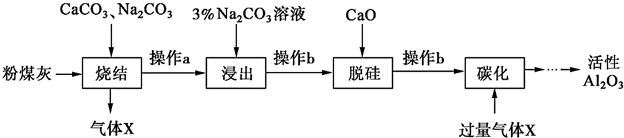
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com